Bonjour à tous !
Je me casse la tête depuis quelques jours sur des conversions de pourcentages élémentaires ou en masse à des pourcentages en oxydes. Voici mon raisonnement, je ne comprends pas où j'ai pu me tromper :
Voilà j'ai ma petite amphibole Mg7Si8O22(OH)2, on considère uniquement la silice et le magnésium car étant pôle pur d'une solution solide, ce sont les éléments qui vont varier. Du coup elémentaire, j'ai : 47% de Mg et 57M de Si.
Maintenant, j'aimerais passer en pourcentage d'oxyde, MgO et SiO2.
J'utilise mes petits facteurs de conversion P(Mg/MgO) et P(Si/SiO2), dans MgO on a 60% de la masse qui vient de Mg, dans SiO2 c'est 47% pour la silice. A ce stade, on a MgO = Mg/P(Mg/MgO). Et là, c'est le drame. J'obtiens 78% de MgO et 110% de SiO2
Est-ce que mes calculs sont mauvais ? Est-ce que je ne regarde pas le problème sous le bon angle ?
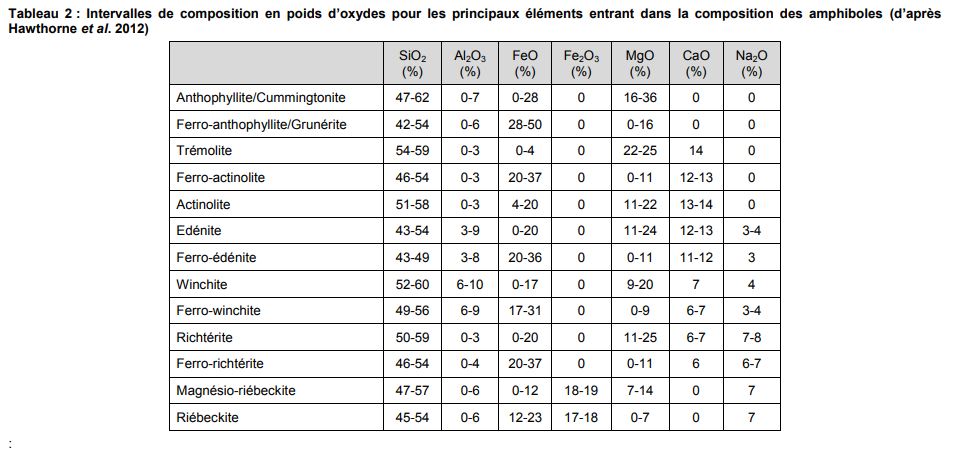
En fait, j'aimerais pouvoir vérifier les résultats de ce tableau :
Voilà, si quelqu'un a une petite idée, je suis preneuse ! Merci d'avance
Laurane
-----