Bonsoir.
J’étudie en ce moment la rectification (distillation fractionnée), je suis confronté à quelque difficulté.
Alors déjà je souhaiterais avoir confirmation qu’il y a une évolution du gradient de température le long de la colonne au fur et à mesure de la distillation ?.[Car comme les proportion du mélange évolue dans le bouilleur il devrait y avoir accroissement de la température].Suivant ce cheminement la pureté du distillat recueillis devrait se réduire proportionnellement (augmentation de la température en bout de colonne -> réduction de la pureté du distillat)?
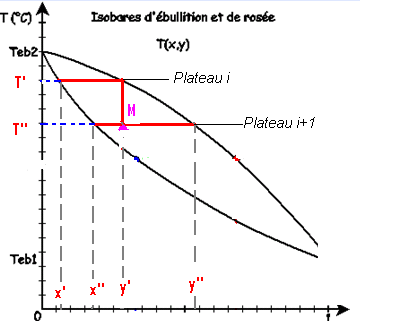
Mais pour quelle raison aurais-je x2=y1 pourquoi une condensation totale et non partielle [voir diagramme ci-joint]A chaque niveau de l'appareil correspond une "marche de l'escalier" inscrit dans le fuseau formé par les courbes d'ébullition et rosée. Le liquide de composition x1 bout à la température T1 et émet de la vapeur de composition y1 qui est condensée au niveau 2. Le liquide de composition x2=y1 bout à la température T2 et émet de la vapeur de composition y2 qui est condensée au niveau 3 et ainsi de suite jusqu'au niveau n dont la vapeur de composition yn est condensée dans le réfrigérant en un liquide de composition xn+1
En faites je me pose la question, lors de la rupture de l’équilibre au niveau d’un plateau, puis le retour de celui-ci, ce sont les nouvelles fractions liquide-vapeur qui régiront la valeur de la température ou bien le contraire.
Quand il y a ascension de la vapeur vers le plateau supérieur (i+1) et ainsi déversement de l’excès de liquide vers le plateau (i), si j’analyse ce plateau (i) à ce moment la : je constaterais un changement au niveau des fractions du mélange (par rapport à ce qui en était un instant plutôt) .Je devrais donc avoir un accroissement de la température au niveau de ce même plateau (comparer en ce qui en était lors du précèdent équilibre).C’est cela ?
Désole s’il y a bon nombre de confusion, j’espère recevoir les éclaircissements voulus.
Merci bien.
-----