Bonjour,
Il y a un aspect physique que je ne saisis pas bien concernant le second principe de la thermodynamique. Et plus particulièrement dans l'exemple suivant concernant une classique machine thermique ditherme fonctionnant en moteur.
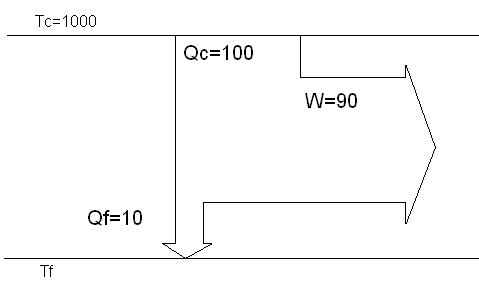
Supposons donc une machine motrice fonctionnant entre une source chaude et une source froide, cette machine capte une quantité de chaleur Qc à la source chaude en transforme une partie en un travail W et rejette le reste Qf à la source froide.
Supposons maintenant que nous imposions les valeurs suivantes respectant le premier principe :
Tc= 1000 °K (température de source chaude)
Qc = 100 J
W=90 J
Qf = 10 J
En effet le premier principe s'écrit sous la forme suivante : Qc-W=Qf
On voit qu'il est bien respecté.
Pour plus de clarté on peut se référer au graphique suivant :
La question maintenant est de savoir quelle doit être la température de la source froide pour une telle configuration, pour cela appliquons le second principe:
Qc/Tc-Qf/Tf= - variation d'entropie
Si l'on fait l'hypothèse que la machine est réversible la variation d'entropie est nulle et l'on trouve que la température de la source froide pour une machine réversible dans cette situation est de Tf=100°K
Ma question de principe est la suivante. Si la source froide était à non pas 100°K mais à par exemple 102°K pourquoi ce ne serait pas possible ?
Mathématiquement je vois bien pourquoi, l'entropie diminue et c'est impossible, mais physiquement, concrètement je ne "sens" pas pourquoi c'est impossible.
Ce non respect du second principe signifierait que quelque part de la chaleur irait du froid vers le chaud ce qui est impossible. Certes mais où dans un tel diagramme aussi simple ? Car même à 102°K la chaleur va quand même du chaud vers le froid ? Alors qu'est-ce qui ne va pas dans mon raisonnement ?
Quelqu'un aurait-il une piste à me fournir voire mieux encore une réponse ?
Je vous remercie d'avance.
-----