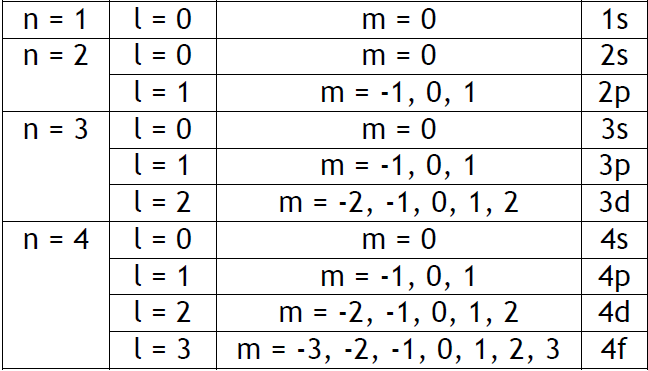Bonjour,
je me demandais s'il existe un moyen de calculer le nombre n (après avoir regardé plusieurs site j'en ai conclus qu'en gros on prend le numéro atomique puis on fait la règle du " K= 2, L= 8, M= 18 etc ", et on compte le nombre de lettres obtenues. Est-ce juste?
A quoi sert 2n² ? Dans les exercices, il y a cette question " Combien d’électrons peut-on loger dans la couche n = 3 ? " , la réponse étant 18, j'en ai conclus que 2n² nous permet de déterminer le nombre d'électrons dans la couche, c'est juste ?
Ensuite, qu'en est-il des sous-couches? Comment les détermine-t-on ? J'ai un exercice dans mon livre qui demande " Combien y a-t-il de sous-couches lorsque n = 2 ou n = 4 ? ". Les réponses sont 2 et 4, sauf que je ne comprends pas pourquoi.
D'après ce tableau, j'aurai dis que le nombre de sous-couches varie entre 2&3 pour n = 2 (1s,2s & 2p) et pour n = 4, qu'il varie entre 7 et 10 (de 1s à 4s, 4p, 4d ou 4f selon le nombre l).
En fait je crois surtout que je n'ai rien compris, serait-il possible d'avoir des explications assez simples? haha.
Comment détermine-t-on le nombre s ? (on est d'accord que la colonne tout à droite n'a rien à voir avec s et est en rapport avec n ?)
Enfin, quelques exercices que je n'ai pas compris (je pense que c'est surtout parce que je n'ai pas acquis la matière de mes précédentes questions):
" Combien y a-t-il d’orbitales dans la couche n = 5 ? " => la réponse est 25, mais je ne comprends pas pourquoi. (et pareil si la question demande combien il y en a pour une sous-couche 5p par exemple)
"Dénombrer les électrons dans une sous-couche l = 3 " => la réponse est 14
Dénombrer les électrons dans une sous-couche 4s => la réponse est 2 "
"Combien d’électrons ont les nombres quantiques suivants dans un atome ? " n = 3 l = 2" " => la réponse est 10
voilà, j'ai mi les exercices en gras pour plus de lisibilité.
Merci d'avance & désolé de poser ce genre de questions qui doivent vous paraitre basique, mais je n'ai jamais vu ça l'année passée & les explications de mon professeur actuel ne me conviennent pas.
-----