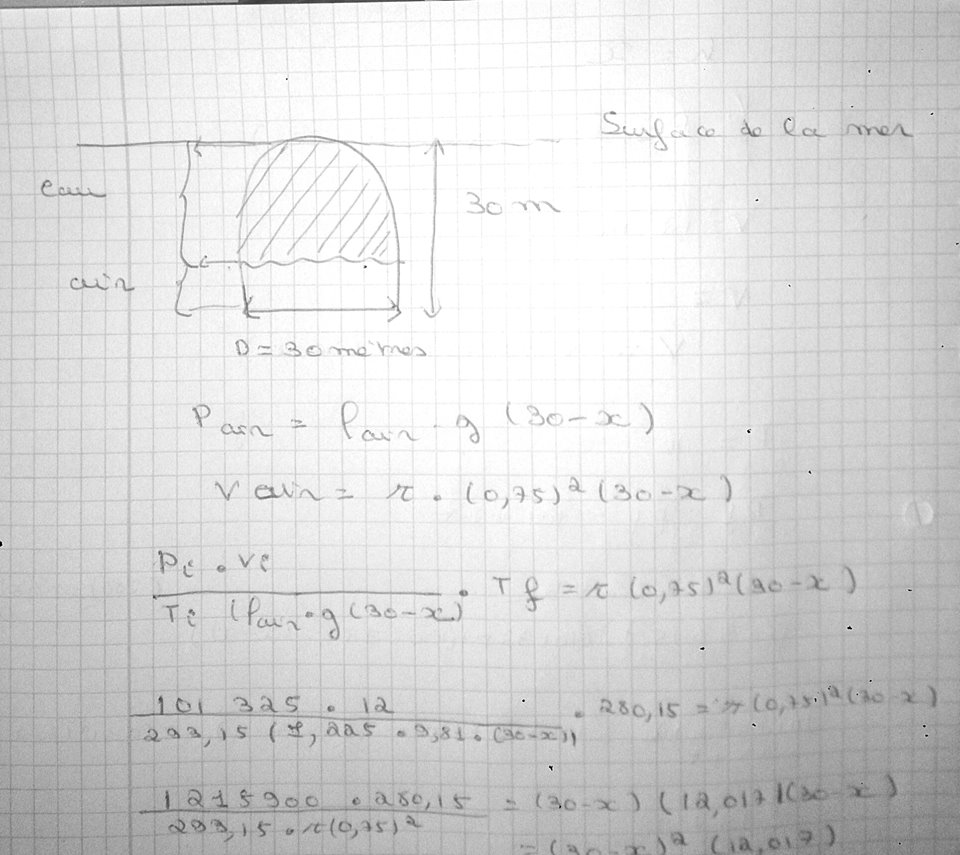
Bonjour à tous je reste bloqué dans un exercice sur les gaz parfait voici :
Une cloche à plongeur de 12m3
de capacité renferme de l'air à la pression atmosphérique
standard et à la température de 20°C. Son diamètre est de 1,5m. On l'immerge dans la mer à une
profondeur de 30 m par rapport au bas de la cloche. Sachant que la température à la profondeur
de 30m est de 7°C, calculer la pression de l'air dans la cloche et le volume qu'il y occupe.
Volume initiale = 12m³
Pression initiale = 101325 Pa
Température initiale = 293.15 K
Température finale = 280, 15
On veut le volume finale et la pression final dans la cloche.
On travail à masse constante d'ou
(Pression initiale*volume initale)/ Température initale = (Pression finale*volume finale)/Température finale
J'arrive pas à degager d'autres équations qui pourrait m'aider à résoudre le problème .
-----





 Bonne soirée
Bonne soirée