Bonjour,
J'ai un exercice avec un compresseur à double étage considéré comme suit :
On y admet du CO2 considéré comme gaz parfaits et dont les transformations subies sont supposées réversibles.
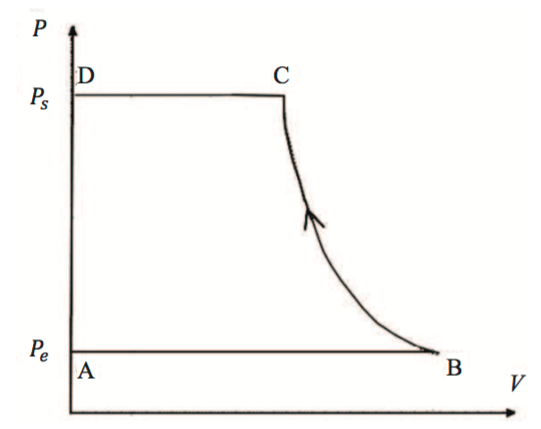
Chaque compresseur a une entrée et une sortie à clapet anti-retour, le gaz ne peut que rentrer par l'entrée 1 et ne peut que sortie sur la gauche du schéma.
Le gaz ne peut passer dans la chambre du piston que lorsque sa pression P considérée comme uniforme est supérieur à une pression Pe.
De même pour la sortie pour la gauche, il doit être supérieur à une pression Ps.
Les chambres de chaque piston sont parfaitement calorifugées.
On a la relation de Mayer cp - cv = R/M
La question étant : On note Tb la température d'admission du gaz au moment de la fermeture du clapet d'admission et Tc la température au moment de l'ouverture du clapet d'échappement.
Montrer queavec
le taux de compression.
Je suppose qu'on doit partir de la relation de Mayer mais j'ai du mal à me lancer.
Toute aide serait la bienvenue. Je vous remercie par avance.
-----





 ) en V.V^(g-1)
) en V.V^(g-1)