Ce topic fait suite à mon premier 'questions en thermo" ou Amanuensis*et mach3 m'ont pas mal éclairé. Je repart sur une nouvelle base pour plus de lisibilité. Je relis les equations et j'essaie de vraiment cerner, mais il manque toujours une pièce au puzzle
Salut,
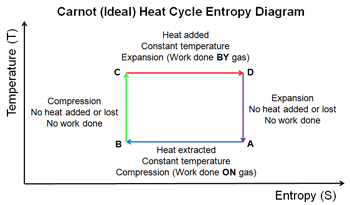
j’essaie de comprendre l’entropie depuis trois semaines, à travers cette question : d’ou vient la perte de rendement du cycle thermodynamique idéal de Carnot ?
Comme un dessin vaux mieux que de longues équations, les shadoks sont la meilleur approche qui soit pour illustrer ma question

https://m.youtube.com/watch?v=duVbSqhpH-c
Regardez à 1:10 minute.
On vois que seulement une partie de la chaleur transmise au milieu isolé est récupéré sous forme de travail mécanique. Mettons 50% des calories on généré un travail mécanique, il reste 50% de calories inexploités. Mais pourquoi perdu ?
Pour moi elle sont exploité à 100% surtout dans le cycle de carnot.
Puisque la différence de température avec le milieu extérieur est une source d’énergie qui peut simplement générer du travail en refroidissant le gaz, qui cherchera a diminuer de volume en déplaçant le piston.
De retour a sa position initiale, avec ses variables d’états initiales, pourquoi le rendement n’est pas de 100% ? Quel que soit la différence de température entre le
point chaud et le froid.
Est-ce qu'on doit compter les calories échangé avec le point froid (ambiant) alors qu'elle n'ont pas couté de carburant ?
merci
-----