Bonjour,
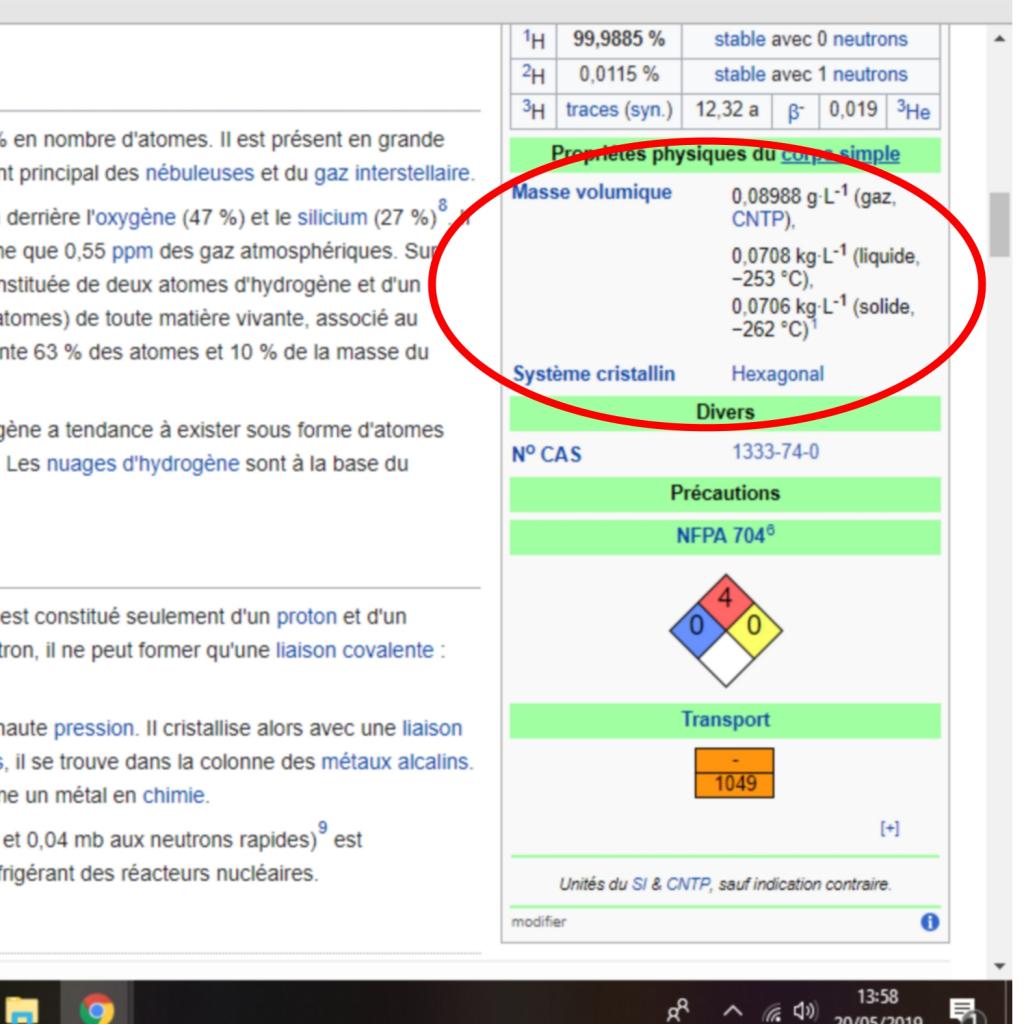
Je voudrais savoir pourquoi les masses volumiques, à l'état gazeux, de l'hydrogène et du dihydrogène sont les mêmes ? C'est à dire 0,08988 g/L dans des conditions normales de température et de pression, soit 0°C = 273,15°K et 101 325 Pa. Pour trouver la masse volumique j'ai utilisé la formule des gaz parfaits : pV = nRT.
J'ai isolé n, pour pouvoir le calculer, et si je ne me trompe pas, n devrait avoir la valeur 0.08988 mol, car une mole d'hydrogène a une masse de 1g. Et il devrait être moitié moins pour le dihydrogène.
Donc, ce que j'ai fait :
pV = nRT (p en pascal, V en m3, n en mole, R constante des gaz parfaits, T température en kelvin)
<=> 101 325 * 0.001 = n * 8,314 462 1 * 273,15
<=> 101,325 = n * 2271,1
<=> n = 0,0446
On a donc 0,0446 mol, comme le dihydrogène a une masse molaire de 2g/mol, alors n*M = m
<=> 0.0446 * 2 = m
<=> m = 0,0892 g
Donc ce résultat me semble cohérent pour le dihydrogène. Cependant, cela fait que je trouve moitié moins de ce résultat pour l'hydrogène simple. Or sur Wikipédia il est dit que l'hydrogène simple à l'état gazeux a la même masse volumique que le dihydrogène, donc je voulais savoir pourquoi. Peut-être me suis-je trompé dans mon calcul ou alors que je n'ai pas utilisé le calcul adéquat ?
Merci d'avance pour vos réponses, bonne journée
-----



 où m est la masse des n moles de gaz parfait. La masse volumique du gaz est donc :
où m est la masse des n moles de gaz parfait. La masse volumique du gaz est donc :
 merci beaucoup votre aide en tout cas ! Bonne journée
merci beaucoup votre aide en tout cas ! Bonne journée