L'exemple proposé illustrait la question que tu avais posée (# 01)
Si tu veux discuter de relations mathématiques, il faut au moins accorder un minimum d'attention aux calculs dans lesquels elles sont impliquées.Un système isolé atteint un équilibre thermodynamique lorsque son entropie est maximale, mathématiquement on écrit que la différentielle de l'entropie
dS=0 mais peut on dire aussi que les dérivées partielles de l'entropie par rapport aux variables du systèmes sont nulles aussi?
1°)C'est au contraire la relation décisive qui permet de caractériser l'état recherché.Ecrire dS=0 pour un système isolé à l'équilibre est parfaitement vraie, mais c'est pas un résultat intéressant ...
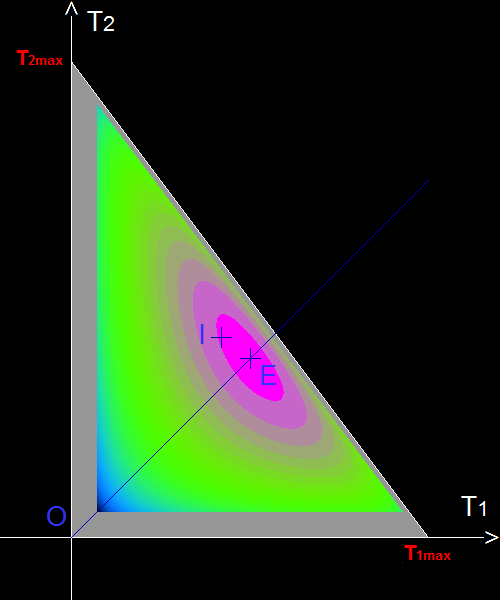
Voir le message (# 11) où a été établie l'expression de la variation élémentaire d'entropie:
dS = m1C1(1/T1 -1/T3).dT1 + m2C2(1/T2 -1/T3).dT2 .
(dS) identiquement nul, c .à d. dS = 0 quelles que soient les variations (dT1, dT2) des températures implique entre autres:
a) pour dT2 = 0 et dT1 non nul: 0 = m1C1(1/T1 -1/T3).dT1 ,
ce qui conduit à m1C1(1/T1 -1/T3) = 0 d'où T1 = T3 ;
a) pour dT1 = 0 et dT2 non nul: 0 = m2C2(1/T2 -1/T3).dT2 ,
ce qui conduit à m2C2(1/T2 -1/T3) = 0 d'où T2 = T3 ;
2°)L'égalité dU = 0) caractérise l'évolution du système, et reste vraie pour tous les états envisagés;PAR CONTRE dS=0 ou dU=0 (je maintiens et je signe) n'IMPLIQUE PAS la nullité des dérivées partielles de S ou de U par rapport aux variables d'état
par contre (dS = 0) n'est vérifiée qu'en un état particulier, l'état d'équilibre recherché.
3°)Si l'on part d'une absurdité - et la relation envisagée dU = -P.dV + T.dS en est une,sinon on arrive aux absurdités du type T=P=0 lorsqu'on a dU=0 par exemple.
on est sûr d'être conduit à d'autres absurdités ! La démarche envisagée n'y est pour rien ...
-----




 pour déterminer x1 correspondant à un extremum.
pour déterminer x1 correspondant à un extremum.