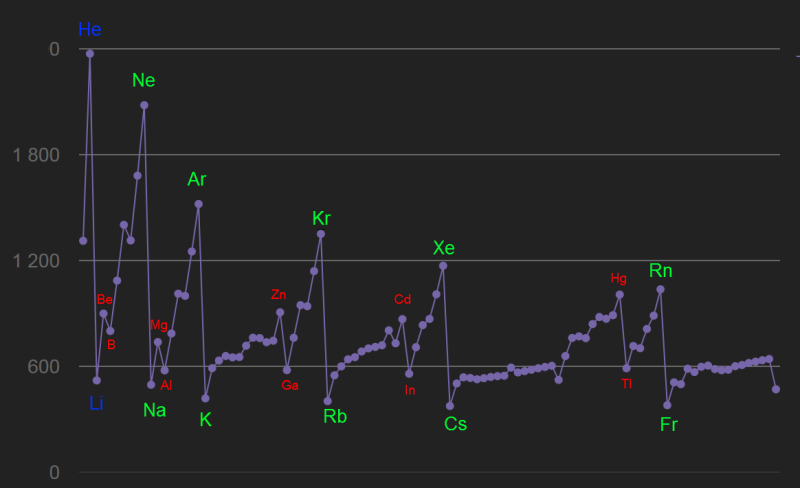
Bonjour,
Je me pose une question par rapport à la stabilité atomique pour laquelle j'ai trouvé une réponse mais qui ne me convient qu'à moitié, si jamais vous avez le temps d'y répondre...
Je ne comprends pas pourquoi un atome est plus stable (et possède donc une énergie globale inférieure) si ses couches électroniques sont plus remplies.
Je comprends que grâce à la mécanique quantique, l'orbitale moléculaire peut être plus stable (moins énergétique) que deux orbitales atomiques grâce à une combinaison liante (si j'ai bien compris une liaison entre deux ondes qui rentreraient en interférence destructive, minimisant ainsi l'énergie globale), mais pour moi cela n'explique pas pourquoi la couche doit être remplie en entière.
Cela n'explique pas la règle de Hund qui énonce que dans un atome ayant sa couche externe à moitié pleine ou moins, le niveau de plus faible énergie est celui minimisant J.
Je dirai même que cela va à l'encontre de ces règles là donc il y a quelque chose que je n'ai pas compris..
Merci d'avance et bonne soirée!
-----




 ] qui a une formation de garçon boucher. Alors quand on cherche à justifier le truc c'est forcement un peu bancal.
] qui a une formation de garçon boucher. Alors quand on cherche à justifier le truc c'est forcement un peu bancal.