Bonsoir, je me pose une question depuis quelques temps :
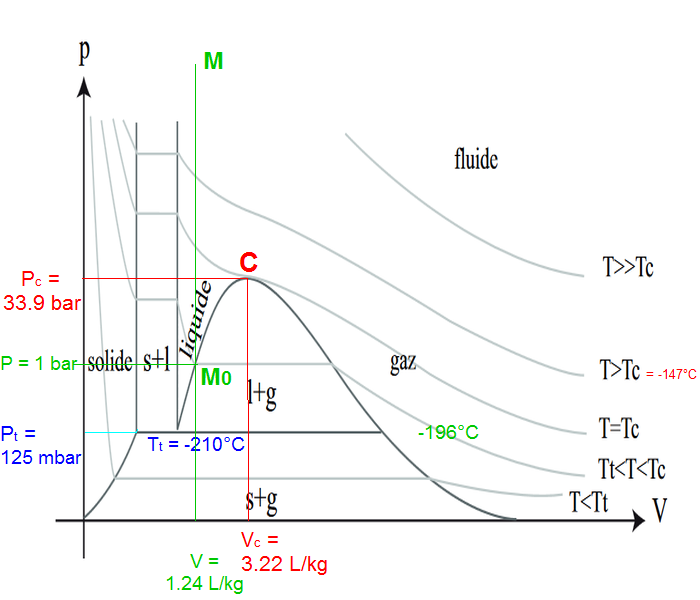
Prenons de l'azote liquide maintenu sous pression dans une bombonne de gaz hermétique et NON isolée( la bombonne est supposée pleine à 100% d'azote liquide et indilatable) Si l'on expose l'azote liquide à une source de chaleur :
- l'agitation augmente t'elle ?
- la température de l'azote liquide augmente t'elle au dessus de son point d'ébullition ?
- l'azote liquide arrive t'il à se transformer en gaz ? (J'imagine que non...)
En bref, la question est de savoir s'il est possible d'obtenir de l'azote liquide au dessus de son point d'ébullition ?
Cela fonctionne sans problème avec de l'eau sous pression que l'on peut chauffer à 200°C par exemple en la maintenant liquide alors je voudrais savoir si oui ou non, l'azote liquide réagit de la même façon.
Cordialement
Rails
-----