On a un alcool, et on veut un acide :
on ajoute de l'anhydride phtalic à l'alcool (là je comprends), et un peu de N,N-diméthylaminopyridine dans de pyridine sèche.La fin je ne comprends pas : pourquoi cette aminopyridine?
S'il vous plait...
-----


On a un alcool, et on veut un acide :
on ajoute de l'anhydride phtalic à l'alcool (là je comprends), et un peu de N,N-diméthylaminopyridine dans de pyridine sèche.La fin je ne comprends pas : pourquoi cette aminopyridine?
S'il vous plait...


Bonjour,
Tu veux oxyder un alcool en acide ?
Je ne connais pas de méthode avec l'anhydride phtalique...
Tu peux en dire plus ?


Bonjour,
Je pense qu'il doit y avoir une suite à la réaction. Généralement tu utilises la N,N-diméthylaminopyridine (ou DMAP) comme activant du groupe OH d'un acide (mettons, RCOOH). L'espèce activée peut alors être attaquée par un nucléophile (Nu) pour donner un R-CO-Nu.


Oui, peut etre que ca marche pas avec l'anhydride phtalique, j'avais la formation d'un acide avec un anhydride dans mon cours.
Sinon, pour en dire plus ca va etre difficile: j'ai un mode opératoire où on met:
- 1 alcool (~100g)
- N,N-diméthylaminopyridine (~0.4g dans 400mL de pyridine)
On mélange et on ajoute ~69g d'anhydride phtalique solide. Puis on chauffe à 100-110°C.
Et tout ce que je sais, c'est qu'on récupère un acide, mais j'aimerais bien savoir "ce qu'il se passe".
Enfin, j'ai peut etre mal compris, c'est d'après une publi, je la met en pièce jointe.


Oui, il y a une suite, en suite on ajoute une amine.
En fait c'est la séparation de 2 alcools (R et S) en formant des diastéréoisomères.


Dommage que Coincoin ne veuille pas valider la publie...
Tu peux faire un schéma stp Chimelo ?
Généralement, la séparation de deux énantiomères par la formation d'un ester est une méthode très utilisée. Seulement, on utilise un acide chiral (typiquement un dérivé de l'acide mandélique) pour former des dia mais je ne vois pas la source de chiralité lorsque l'on utilise l'anhydride phtalique...


Bon, en fait la pièce jointe n'est pas acceptée (pb de copyright) alors si vous voulez plus d'infos dites moi, j'essaierai de vous les donner!
Mais si vous pouviez résoudre mon problème...


Pourrais-tu donner la référence de la publi en question ?


Publi :
"Efficient, Large-Scale Preparation of (R)-and (S)-1-(2,4,6-Triisopropylphenyl)ethanol, Versatile Chiral Auxiliary for Cyclopentenone, gama-butyrolactone, and gama-Butyrolactam Synthesis"
Auteurs : Philippe Delair, Alice M. Kanazawa, Mariangela B. M. de Azevedo, and Andrew E. Greene.
Tetrahedron : Asymetry, Vol. 7, No 9, pp 2707-2710, 1996.


En fait la chiralitée est déjà présente dans l'alcool:
1,3,5-triisopropylbenzène + acide de Lewis + CH3COCl +CS2 donne la 1-(2,4,6-triisopropylphenyl)ethanone (le CS2, je ne sait pas à quoi ca sert).
Ensuite réduction par LiAlH4, ce qui donne l'alcool correspondant.ET C'EST CET ALCOOL QUI EST CHIRAL.


OK, je viens de lire la publie et je comprends mieux
Je te fais un schéma et on parle après


Ok merci!!!


Voici ce que je propose :
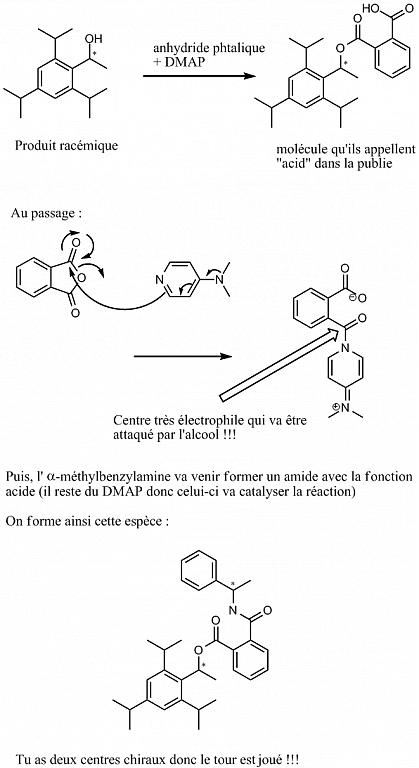


Pour t'expliquer le début de la synthèse, tu fais dans un premier temps une réaction de Friedel & Craft (CS2 est le solvant de la réaction) puis tu fais une réduction par LiAlH4 donc donc alcool est racémique puisque la réduction d'une cétone par cette méthode n'est pas énantiosélective. D'ailleurs, ils mentionnent dans la publie qu'il existe d'autres méthodes (CBS...) mais que l'ee est faible donc ils ont réalisé cette méthode dite de dérivationEn fait la chiralitée est déjà présente dans l'alcool:
1,3,5-triisopropylbenzène + acide de Lewis + CH3COCl +CS2 donne la 1-(2,4,6-triisopropylphenyl)ethanone (le CS2, je ne sait pas à quoi ca sert).
Ensuite réduction par LiAlH4, ce qui donne l'alcool correspondant.ET C'EST CET ALCOOL QUI EST CHIRAL.


Merci, mais jusque là j'avait compris, sauf CS2.
Sinon, j'attends la validation de la pièce jointe...

Pièce jointe validée !



