bonjour,
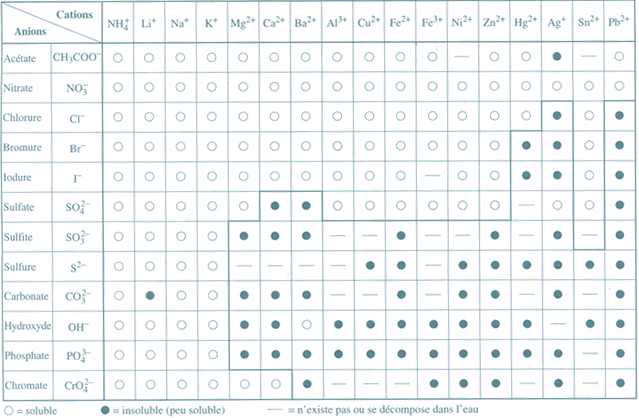
dans un exercice on mélange du nitrate d'argent et du chlorure de sodium, je sais que le nitrate d'argent réagit avec l'ion chlorure et on me demande le nom et la formule du précipité donc l'équation:
je pense que l'équation bilan est : AgNO3 + NaCl -> 2 Ag+ + NO3- + Cl- Na+
pouvez vous m'aidez svp merci d'avance.
-----