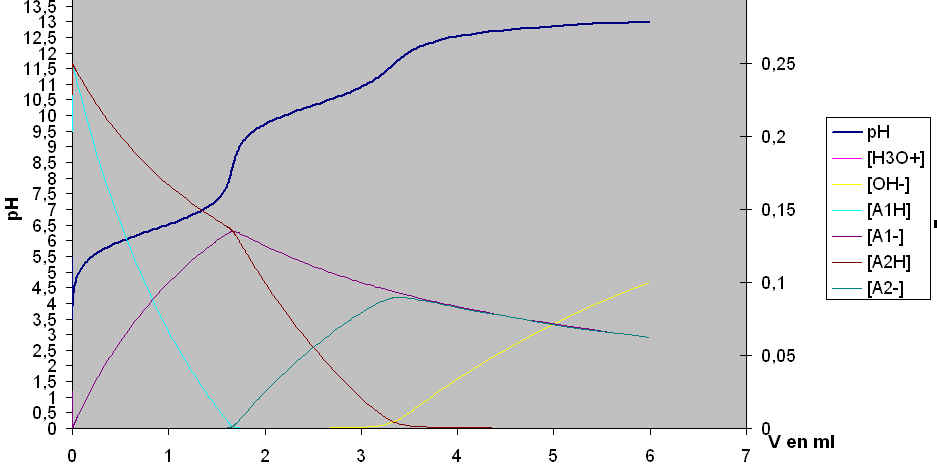
Voici: dans le protocole de dosage du CO2 par titrimétrie (avec pHmètre et acide sulfurique) on peut lire:
"1 ml de solution d’acide sulfurique réagit avec 0.44 g de dioxyde de carbone"
Mon problème est que je n'arrive pas à trouver d'ou ils sortent leur 0,44
données:
solution d'acide sulfurique 0,05M
CO2 sous forme de carbonate bloqué avec de la soude puis hydrogénée ( H2CO3) par une enzyme: l'anhydrase carbonique
Merci de votre aide
-----