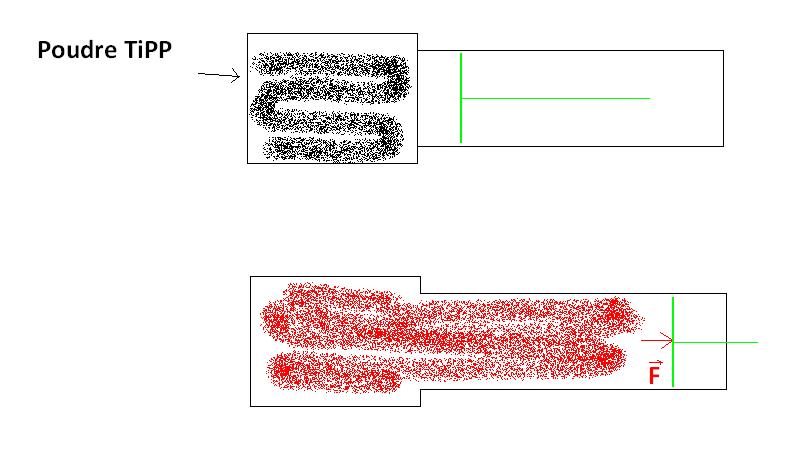
Bonsoir,
J'ai un petit problème que je n'arrive pas à résoudre.
Donc j'ai un système avec deux chambres, une avec de la poudre de TiPP (noir), l'autre avec un piston (vert).
Je fais exploser la poudre (la paroi entre les chambres s'ouvre), ce qui fait augmenter la pression et déplacer le piston.
J'ai séparé en deux réactions, d'abord l'explosion, puis la poussée.
L'équation de la réaction est:
4TiH 2 + 3KClO 4 = 4TiO 2 + 4H 2 O + 3KCl
J'ai cherché les différentes enthalpies (avec beaucoup de mal):
TiH2(s) : -119.7kJ.mol-1
TiO2(s) : -939.7kJ.mol-1
KCl(s): -436.7kJ.mol-1
KClO4(s): -432.8kJ.mol-1
H2O(g): -241.8kJ.mol-1
ps: si ça intéresse certains, voici une table d'enthalpie très complète
Après j'ai calculé l'enthalpie de formation de cette réaction via la loi de Hess.
Résultat ΔrH0 = -4258.9kJ.mol-1
Donc à la première réaction, j'ai appliqué le 1er principe:
ΔU = Q + W, or pas de partie mobile, donc ΔU = Q
Ensuite, ΔH = ΔU + P1V1 donc ΔU = ΔH – P1V1 = Q
Donc là, je trouve Q, la chaleur dissipé par la réaction.
Puis deuxième réaction, j'ai supposé adiabatique. Donc ΔU = W = - int( Pext * dV )
Mes problèmes:
Je ne suis pas sûre de la valeur de:
-P1, je pense que c'est la pression atmosphérique.
-V1, je pense que c'est le volume occupé par la poudre TiPP
Donc la masse de poudre * la densité. La masse est de 160mg, mais la densité ??? aucune idée (je vais essayer de la trouver).
-Pext, je pense que c'est la pression atmosphérique.
Mise à part ça, je ne sais pas comment résoudre le problème. Car il me faudrait la pression dans la chambre pour connaitre l'effort appliqué au piston. Et là ... ???
Je vous remercie d'avance pour votre aide.
ps: je sais que je dois trouver un effort de 2000N.
-----