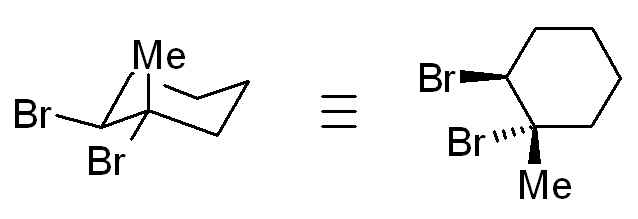Bonjour,
J'ai 1 question concernant la conformation chaise la plus stable du produit obtenu par bromation d'un méthylcyclohexène, le méthyl étant sur 1 des C de la double liaison. C'est en trans que les Br se mettent et je sais que c'est le groupe le plus encombrant qui doit se mettre en position équatoriale mais comment je fais si il y a déjà 1 méthyl sur un des C de la double liaison (et donc savoir si c'est le CH3 ou le Br qui est le plus volumineux?). C'est pas très clair mais j'ai de l'espoir quand même...
Tout autre chose : on demande dans un de mes exercies, de justifier que l'hydrogénation de l'éthylène est avantageux d'un point de vue thermodynamique.
Pour cela, j'ai des chaleurs de dissociation C=C 610kcal, C-H 417, H-H 435et C-C 347 dans un tableau. Je suppose que je dois calculer d'un côté les liaisons rompues et d'un autre les liaisons créées. Mais comment je mets un signe + ou -? Le + c'est quand je donne de l'énergie pour rompre et le - c'est quand je les forme? Ca donnerait en rompu : 1C=C (et 1 C-C? ou 610 c'est jusque C tout seul?) 1 H-H et en formé : 1 C-C (ou pas?) et 6 x C-H?
Et Puis-je justifier que c'est thermodynamiquement avantageux mais qu'il faut un catalyseur pcq il y a une énergie d'activation importante?
Je suis un peu perdue à quelques jours de mon examen alors merci d'avance pour votre aide.
-----