Bonsoir à vous
Je me demandais, quel est ce principe de stabilisation par mésomérie de l'ion ?
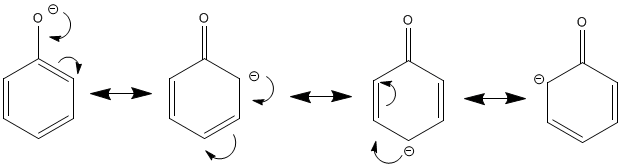
J'ai compris que la charge négative porté par l'oxygène pouvait être transposé sur 3 carbones de l'ion et que l'on se retrouvait donc avec 4 formes mésomères...
Mais, pourquoi 3 carbones seulement ? Dans l'ion phénolate nous avons 6 carbones... Pourquoi cette charge négative ne peut être transposé sur les 6 carbones ? Ce qui ferait 7 formes mésomères...
Et puis comment à partir d'une stabilisation par mésomérie d'un ion qui joue le rôle de base dans un couple, peut-on en déduire la forte acidité de son acide conjugué ?
Le phénol, acide conjugué de l'ion phénolate est plus acide que l'alcool car l'ion phénolate (la base) est stable.... Oui, OK mais pourquoi ?
Je mets en gras les questions auxquelles j'aimerais avoir une réponse. Si quelqu'un pouvait me répondre, ça me serait d'une grande aide. Merci
PS : les deux derniers trucs en gras veulent dire la même chose ou tout du moins attendent la même réponse mais bon... J'arrive pas à m'empêcher de me répéter...
-----







 là n'est pas mon soucis en fait
là n'est pas mon soucis en fait 

