Bonjour,
Je suis entrain d'apprendre l'oxydation des alcènes et je bloque déjà sur l'oxydation douce. Je comprends comment on forme un époxyde (peracide) mais alors quand il s'agit de passer d'un epoxyde à un alpha-diol je comprends pas le cheminement.
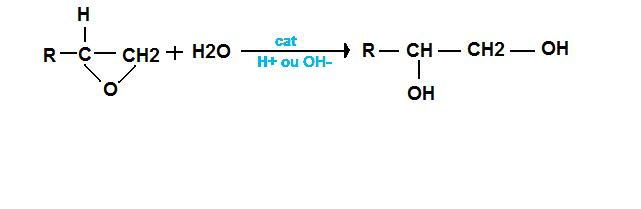
Dans le cours on me dit: En milieu acide ou basique et en presence d'eau, les epoxydes forment facilement des a-diols:
Les images, libres de droit, sont à héberger sur le forum. Pour la modération, HarleyApril
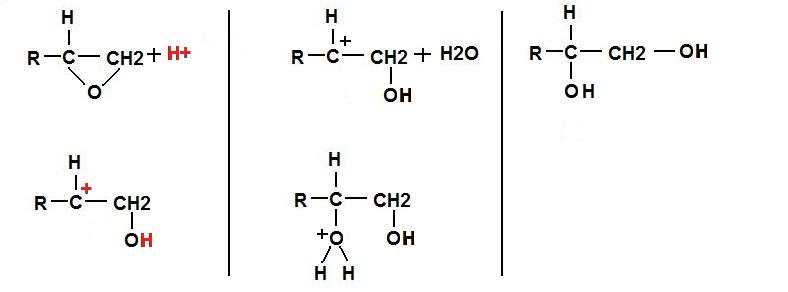
Donc au depart on a un alcene qui correspond à la premiere formule sans le H2O. Il faut lui rajouter un H+ pour la catalyse mais je vois pas ou il va enfaitLe proton va sur le carbone le plus substitué c'est ca ? Et l'atome d’hydrogène il va ou ?
Si quelqu'un peut m'aider, merci.
-----





 Donc forcément c'est un des doublets de l'oxygène qui va se lier au proton catalyseur, pour former une lacune en éléctrons sur le proton... Cette lacune va évidemment être comblée par une des 2 liaisons C-O de l'époxyde, aboutissant à sa rupture tjrs du côté le plus fragile (donc le plus substitué). Cette rupture aboutissant à un carbocation, il est facilement attaquable par une molécule d'eau (en mil aqueux) pour redonner le H+ catalyseur !
Donc forcément c'est un des doublets de l'oxygène qui va se lier au proton catalyseur, pour former une lacune en éléctrons sur le proton... Cette lacune va évidemment être comblée par une des 2 liaisons C-O de l'époxyde, aboutissant à sa rupture tjrs du côté le plus fragile (donc le plus substitué). Cette rupture aboutissant à un carbocation, il est facilement attaquable par une molécule d'eau (en mil aqueux) pour redonner le H+ catalyseur !