Bonjour à tous !
Je suis en phase de rattrapage de ma deuxième année de pharmacie. J'ai quelques (?) soucis en chimie analytique.
J'ai quelques questions à vous poser sur l'ampérométrie (imposer une ddp entre les électrodes et mesurer l'intensité du courant qui circule entre elles) :
J'ai sur mon cours un graphe avec plusieurs courbes d'équation I=f(E). Le problème est que je ne comprend pas à quoi correspondent ces différentes courbes.
J'ai un exemple :
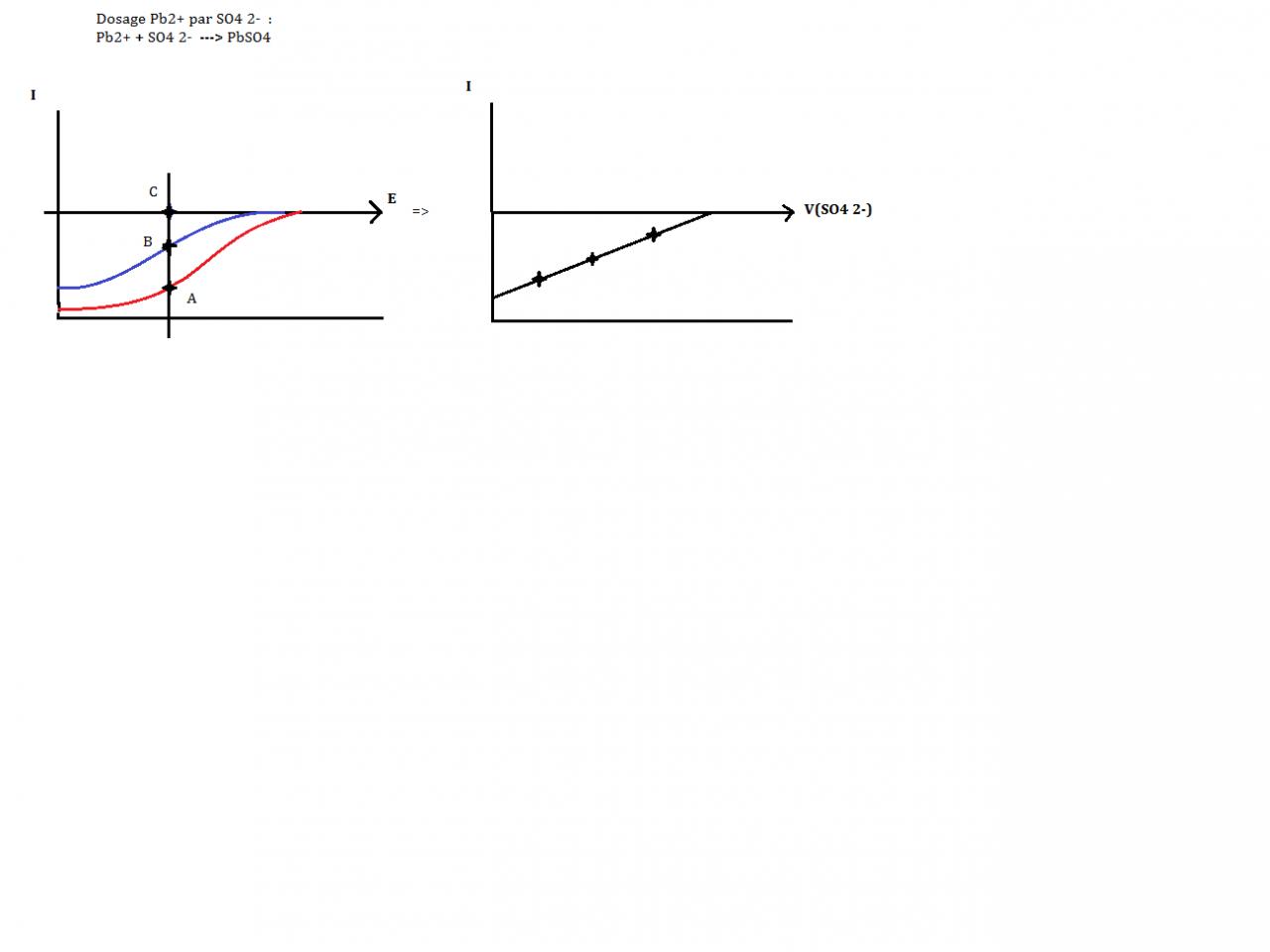
dosage de Pb2+ par SO42- ce qui donne : Pb2++ SO42- --> PbSO4.
Voilà clairement ce que j'ai sur mon cours : (fichier joint)
Mais pourquoi deux courbes? Et les points A B et C seraient 3 points d'équivalence?
Voilà ce qui me gêne dans mes révisions... d'autant plus qu'elles se posent également en Potentiométrie...
Alors si quelqu'un peut m'aider, je le remercie d'avance!
J'attends vos réponses avec impatience!!!
-----