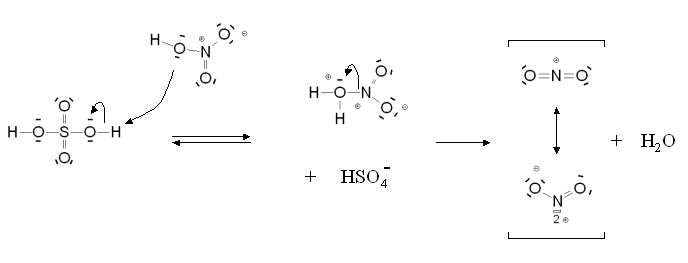
Pour une nitration, si je mélange de l'acide nitrique et de l'acide sulfurique:
H2SO4 donne un H à HNO3 pour faire un ion nitronium NO2^+ et un H2O
Ou y a-t-il deux H2SO4 qui donnent chacun un H à un HNO3 pour faire du NO2^+ et un H3O^+ ?
Et pourquoi?
Merci.
-----