Bonjour, Je suis opérateur en usine et travail avec du NH3.
J'aimerai apporter une amélioration à un procédé, mais je manque de connaissances et j'aimerai poser des questions simples, auquels j'ai besoin de réponses simples....
J'ai compulsé les infos que j'ai pu glaner sur le net, voici ce qu'il en ressort, j'aurais besoin de confirmation et de réponses avant de poursuivre mon étude. Pour présenter mon projet, je préfére utiliser les mots justes.
Merci a ceux qui se prendront le temps de m'éclairer.
Pour info je ne suis titulaire que d'un BEP génie chimique....
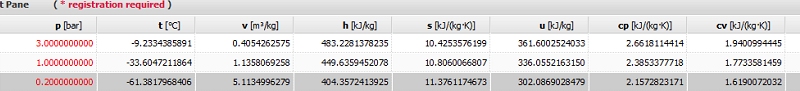
1. est t'il juste de dire que la tension vapeur NH3 à 3 Bars absolue est de -9°C ?, mes valeurs justes ?
2. existe t'il des tableurs permettant de donner la tension vapeur en fonction de la pression (je galere sur des courbes approximatives !), ou alors une equation permettant a ma calculette de tracer une courbe ?
3 La solubilité dans l'eau, à 2 bars 716 g/L, donc a 2 bars environs 36% de concentration représente la solubilté max (saturation) NH4OH ?
4. 10 M3 de NH3 GAZ, représente une masse d'environs 7.3 kg. Juste? Qu'importe la pression ?
5. Si je plonge une bonbonne de NH3 dans un volume d'eau suffisant pour permettre une dissolution sans passer au dessus de la saturation, et que j'ouvre la bonbonne , vais-je absorber le NH3, ?
6. J'obtiendrais du NH4OH? ammoniaque en solution ?
7. Dans mon principe je désirerai dissoudre (absorber?)10 M3de NH3 gaz dans un ballon d'eau adapté en volume et mis sous vide (100 mBars Abs), sans utiliser de tour d'absorpsion , juste un diffuseur ! !
-----