Bonjour et merci d'avance pour la réponse providentielle que j'espère
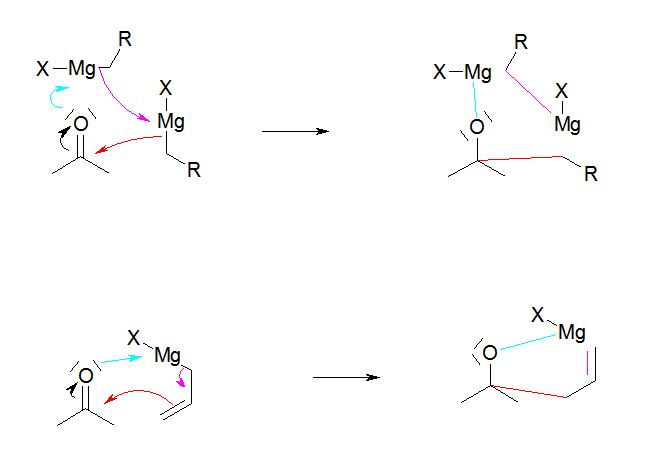
Voila mon problème : je suis en PCSI et on vient de commencer le chapitre des organomagnesiens Mixtes, comment on le forme, etc . . .
Mais je n'arrive pas à bien comprendre pourquoi on ne parle des OMgR que comme nucléophile comme base de Lewis : j'ai compris pourquoi vu qu'il y a un site base de Lewis/Brönsted sur le carbone chargé du fait des electronegativités mais il y a aussi un Mg avec 2 lacunes qui forme aussi un acide de Lewis, donc pourquoi celui-ci n'est pas mis en avant ? Cerait-ce à cause du fait qu'il a déjà à proximité tous les electrons qui lui faut ou autre chose ? J'avoue avoir du mal à comprendre pourquoi on n'en parle pas dans mon cours de ces 2 lacunes.
En espérant avoir été le plus clair possible et de ne pas avoir réouvert un post déjà fait que je n'aurais pas vu ^^
Merci d'avance
-----





 .
.