Bonjour à tous !
Je suis actuellement en 1èreS et dans le cadre d'un TPE sur le diamant, j'étudie sa structure. Mais certains points ne sont pas clairs...
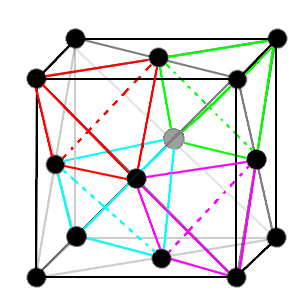
Ainsi, sur ce schéma,les sommets qui ne sont liés à aucun autre atome de carbone sont ils des atomes de carbone ? Je pense que oui, car le concept
même de la structure de type "diamant" est de posséder 1 atome à chaque sommet du cube, mais les schémas me font douter et je n'arrive à trouver aucune précision et étayeraient ou
réfuteraient mon opinion. Et dans le cas où se sont des atomes de carbone, comment sont-ils liés au reste des atomes ?
Merci d'avance pour votre aide !
-----