Bonjour pouvez vous m'éclairer svp ? merci d'avance.
N2O5gaz----------> 2 NO2gaz+ (1/2)O2gaz
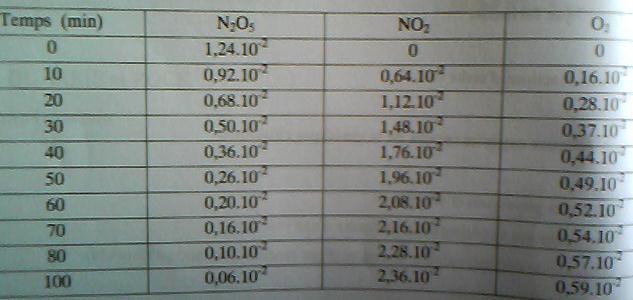
Les concentrations (mol.l-1) en N2O5, NO2 et O2 sont donnés dans le tableau suivant:
Avec pour la colonne des 02 que des 10^-2 ( 0,16.10-2...) qu'on ne voit pas très bien sur la photo.
On me demande quelle est la vitesse de disparition de N2O5, 50 minutes après le début de la réaction? Comparer avec les vitesses d'apparition de NO2 et de O2 au même instant ? Quelle est la vitesse de la réaction à t= 50 min.
Je ne comprend pas dans la correction pourquoi on a :
vN2O5= (1/Va)* (d[N2O5]/dt)= -(d[N2O5]/dt)
Pourquoi le (1/Va) a disparu ? Pourquoi il y'a maintenant un "-" devant le -(d[N2O5]/dt)???
-----