Bonsoir,
Je me pose une question pour laquelle je n'ai pas trouvé de réponse sur le forum.
En effet je voulais savoir si un pka élevé ( donc une base forte ) avait une plus grande chance d'attaquer un site faible en electron ?
Ex :
Les pka sont en orange :
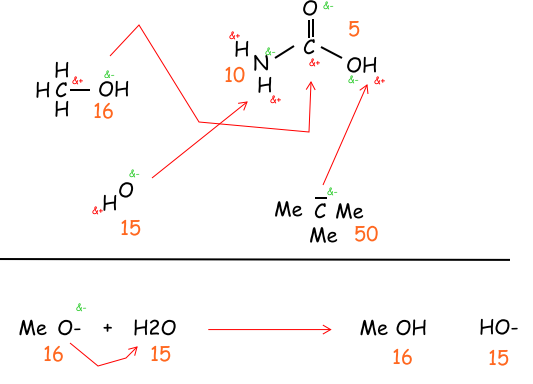
Avec toutes les molécules présentes dans la partie du haut, clairement le carbanion va chopper l'hydrogène de l'acide carboxylique. Ensuite, la soude va prendre l'H de la fonction amine ( car le pka de HO- est de 15 alors que celui de l'amine est de 10 ). Enfin, L'alcool va attaquer le carbone déficitaire, car il est de pka 16, alors que l'H2O formé n'est que de pka 15 donc à moins de "force" pour attaquer le site.
C'est bien ca?
Du cout, si on avait eü ces mêmes molécules, mais avec une : Me-C(=O)-Me, à la place de la molécule du haut ( l'acide aminocarboxylique), là c'est le carbanion qui aurait attaqué le carbone déficitaire de la cétone ( ou il aurait attaqué le H de l'alcool ? ), par contre il n'aurait pas attaqué en premier le carbone déficitaire de l'alcool, car celui de la cétone est plus déficitaire à cause de la liaison C=O d'une cétone ?
( donc du cout le pka de la cétone est plus élevé que celui de l'alcool, car l'oxygène de la cétone donne plus d'electrons à l'oxygène, et il a donc plus de facilité à capter un proton ? )
Enfin, dans la figure du bas, si dans les produits, HO- nouvellement formé n'attaque pas le Me pour jarter OH par une SN1, c'est parceque le OH de l'alcool à un pka de 16 et que celui de la soude n'est qu'à 15?
Autre exemple, si on met un (Me)3-C(&+)-O(-) avec un (Et)3-C-O-, c'est l'oxygène du (Et)3-C-O- qui va attaquer le carbone déficitaire du (Me)3-C(&+)-O(-), car l'oxygène du (Et)3-C-O- a un pka suppérieur à celui du (Me)3-C-O(-) ?
Je cherche des moyens de trouver qui attaque qui en premier, car même si je connais mes réactions "type", je ne sais jamais quel nucléophile attaque en premier
Merci d'avance!
-----





 sérieusement, le HO- qui attaque le C du méthanol pour libérer un HO-... ça n'a pas de sens, faire réagir un réactif sur un autre pour obtenir ce même réactif....
sérieusement, le HO- qui attaque le C du méthanol pour libérer un HO-... ça n'a pas de sens, faire réagir un réactif sur un autre pour obtenir ce même réactif....