Bonjour à tous !
Alors voilà je bloque à un endroit.
J'ai une réaction qui se fait : acétone + I3- + H+ -> acétone-I + 2I- + H+
ou l'on a un excès d'acétone et de prontons H+.
Donc v = k' x [I3-]^c
On a : v = k x [acétone]^a x [H+]^b x [I3-]^c
J'ai déterminé que l'ordre partiel des ions triiodures était 0.
=> v = k x [acétone]^a x [H+]^b
=> v = k' (si je ne m'abuse)
Nous avons 3 solutions ou l'on fait varier l'acétone et H+.
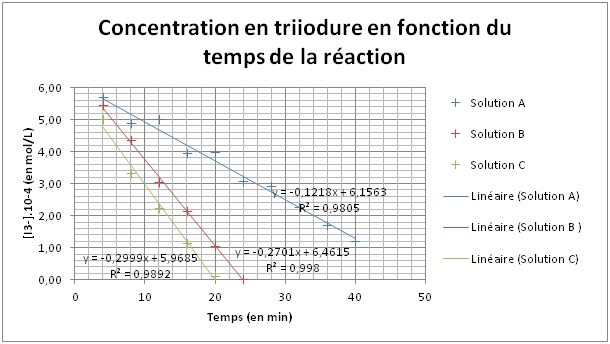
Lors du TP, grace à l'absorbance du triiodure, on a pu obtenir le graphique suivant :
Comment on le trouve à partir du graphique. Est ce que c'est la pente ? Car elle est négative... :/
Je ne connais pas l'ordre partiel de l'acétone (a), ni de H+ (b).
Merci d'avance pour votre aide !
French2291
-----






 acetone)1 et ( acétone )2 les constantes k' etant respectivement k'1 et k'2 tu as la relation
acetone)1 et ( acétone )2 les constantes k' etant respectivement k'1 et k'2 tu as la relation