Donc,
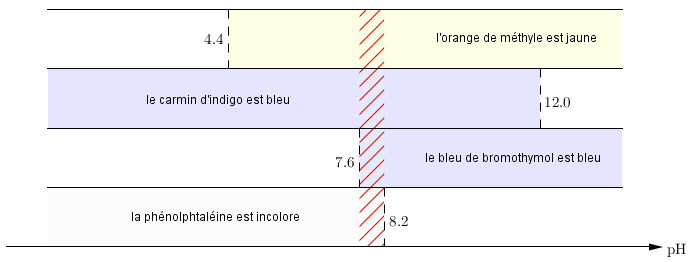
Indicateur Changement de couleur Point de virage
Orange de méthyle Du rouge au jaune 3,0 à 4,4
Carmin d'indigo Du bleu au jaune 12,0 à 14,0
Bleu de bromothymol Du jaune au bleu 6,0 à 7,6
Phénolphtaléine D'incolore au fuchsia 8,2 à 10,0
''Déterminez le pH approximatif d'une solution inconnue si vous avez obtenu les résultats suivant avec les indicateurs. ''
Orange de méthyle : Jaune
Carmin d'indigo : Bleu
Bleu de bromothymol : bleu
Phénolphtaléine : Incolore
4,4 ≤ 12,0
12,0 ≥ 7,6
7,6 ≤ 8,2
C'est tout ce que j'arrive à en déduire, mais il manque quelque chose. Évidemment.
-----





 et
et 