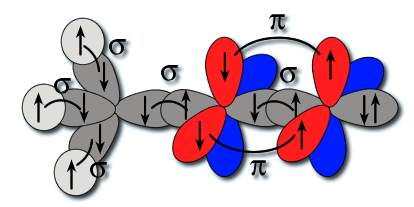
Bonjour , j'ai une petite question sur les orbitales moleculaires
je sais que pour les molecules homonucleaires il peut y avoir une interaction ( Li , Be, B , C , N )
est ce que l'interaction peut aussi avoir lieu avec une molecule heteronucleaire du genre ... CN par exemple ?
ou l'interaction ne s'applique que sur les homonucleaires?
-----









 et
et