Bonjour à tous
En Première année de médecine en chimie organique on nous a présenté les effets électroniques inductifs et mésomères dans le carde de la réactivité par voie radicalaire.
Je me demandais alors pourquoi -(C=O)R avait un effet mésomère attracteur et d'un coup avec -OH l'effet devenait donneur.
Et pour le groupe carboxyle qui contient un carbonyle et un hdroxyle son effet mésomère est il donneur ou attracteur et pourquoi ?
En règle générale qu'est ce qui peut me permettre de savoir intuitivement si l'effet mésomère sera attracteur ou donneur ? Ou alors les chimistes le savent-ils de manière empirique ?
Concernant les effets inductifs pour quelle raison le groupe phénol avait un effet inductif attracteur ? Est ce à cause de certaines formes mésomères limites faisant apparaître un carbocation qui souhaitera récupérer ses électrons ?
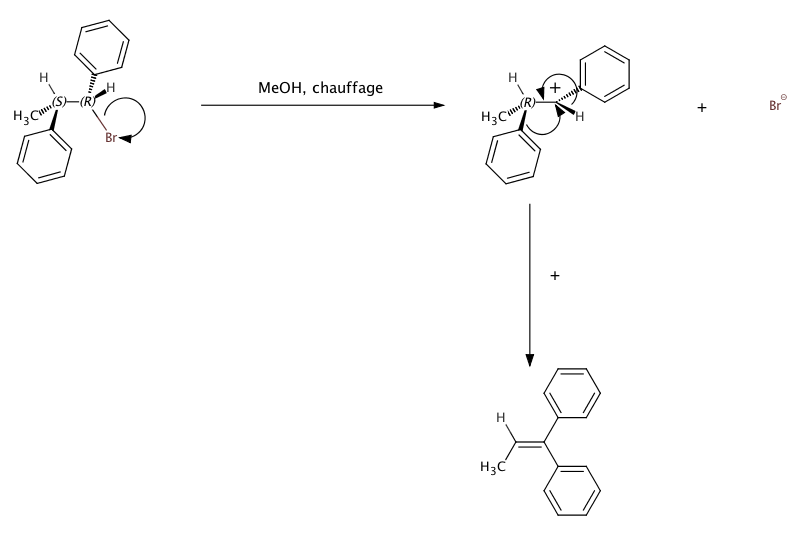
Finalement dans le livre écrit par notre professeur j'ai vu un exercice ou la réaction se faisait par un transfert sigmatropique pour former un alcène. Dans quel cas on observera ce genre de réactivité ?
Merci à ceux qui me répondront et bonne journée.
-----