Bonjour,
Je travaille en ce moment sur des annales en vue de mes examens de janvier et je bloque sur une question toute bête qui m'empêche de faire la suite des questions. Voici l'énoncé :
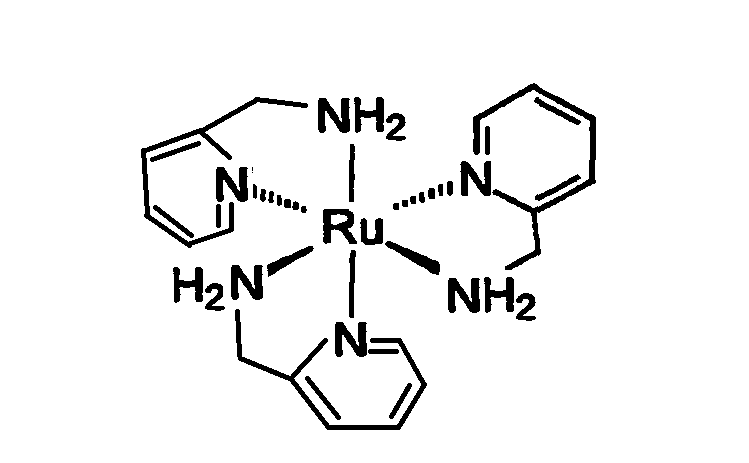
II. Soit le ligand 2-(aminométhyl)pyridine, (noté ampy) :
1. Après avoir donné la définition de la denticité, précisez celle de ce ligand.
2. Combien de ligands ampy peuvent au maximum se lier au cobalt (III) dans une géométrie octaédrique ? Quelle sera la charge globale du complexe (noté 1)?
=> c'est ici que je bloque. Est ce possible que 3 ligands ampy se lient au cobalt (III) ?
3. Ce ligand peut-il être considéré comme symétrique ? Proposez un formalisme simplifié afin de représenter ce ligand.
Etc...
Merci d'avance pour votre aide
-----