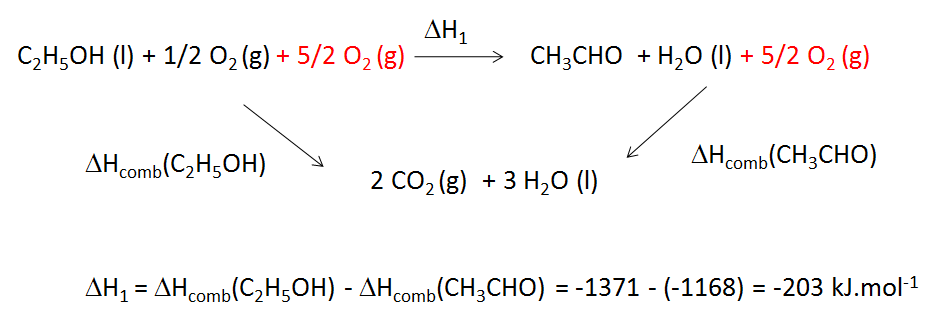
La bactérie « acetobacter suboxydans » tire l’énergie nécessaire à sa croissance de l’oxydation de l’éthanol C2H5OH en éthanal H3CCHO (acétaldéhyde)
1- Calculer la valeur de l’enthalpie de la réaction d’oxydation de l’éthanolen éthanal.
La réponse sera exprimée en kJ·mol-1 et arrondie à l’unité
Données:
enthalpie standard de combustion de l’éthanol -1371 kJ·mol-1.
enthalpie standard de combustion de l’éthanal -1168 kJ·mol-1
Je me suis tapé la tete contre un mur toute l'après-midi sur ça, j'ai des bonnes notions de H S G,
je sais que avec la loi de Hess on peut dire que
Si je veux trouver A + B=> D
Et que je sais que A + 1/2B => C et C + 1/2B => D
Donc A + 1/2B + 1/2B + C => C + D
=> A + B => D
Ca me fait vaguement penser à ça mais ce schema est sans queue ni tête pour moi...
Merci a mon probable futur sauveur. (Au niveau théorie, pour moi un composé qui s'oxyde c'est juste un réducteur qui gagne un éléctron. (ici un seul).
Et une combustion un composé qui réagit avec O2 pour faire de la chaleur de l'eau et du CO2.
Merci donc a monprobable futur sauveur !
-----