Bonjour à tous,
Je suis en pleine rédaction de mon TPE sur la cristallisation du sulfate de cuivre et j'aurais besoin d'une grande aide!
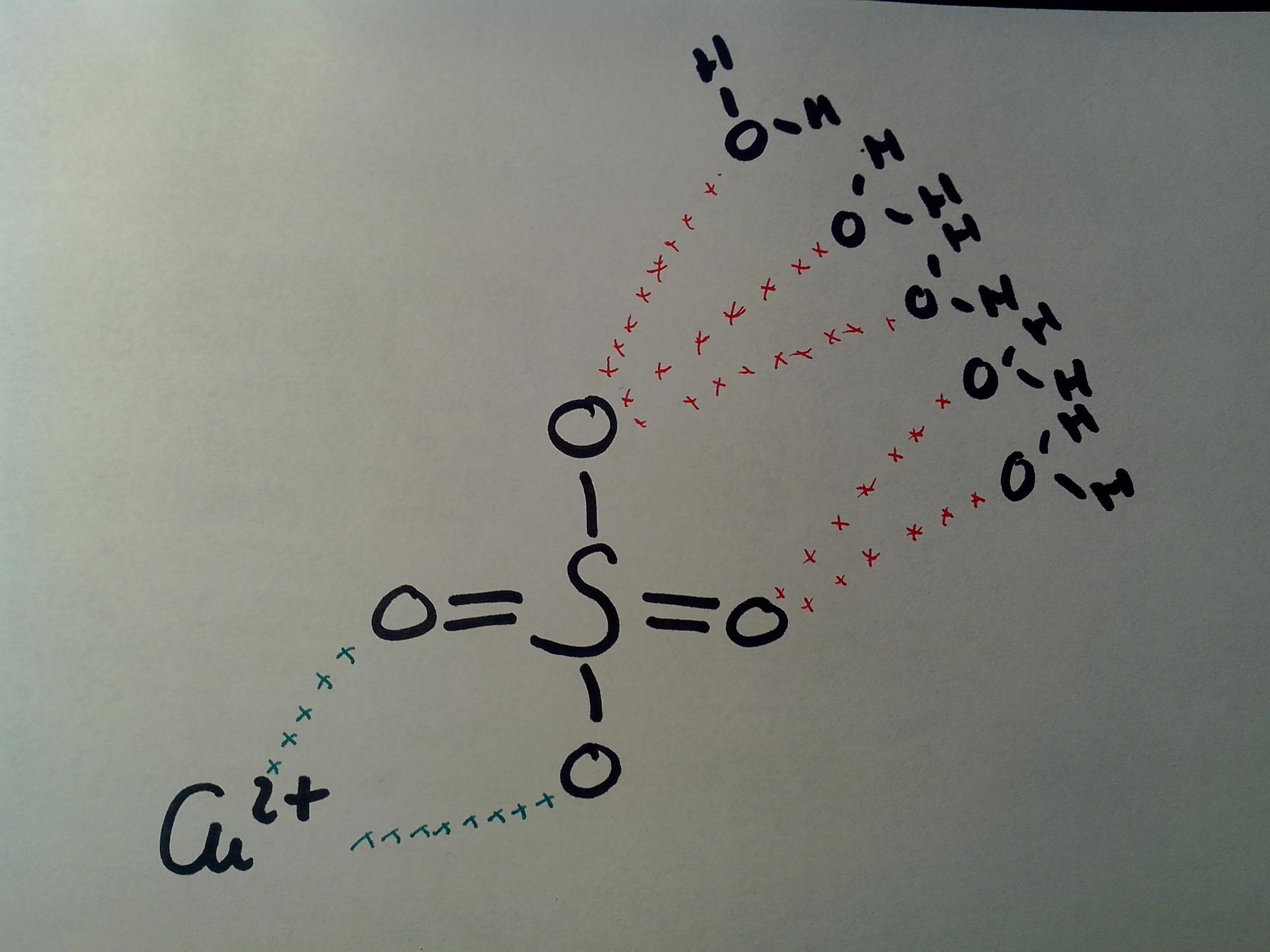
Je cherche à représenter la maille élémentaire d'un cristal, mais je ne suis absolument pas sur de ce que je suis en train de faire...
Je vous joins une photo de ce que j'ai fais pour le moment:
Notez bien que les croix vertes symbolisent une liaison ionique et les croix rouge une liaison hydrogène!
Je ne sais donc pas si cette représentation est bonne, ni, si elle l'est si elle représente une maille entière...
Je vous remercie d'avance pour votre aide qui me sera précieuse!
Clément.R
-----