Bonsoir,
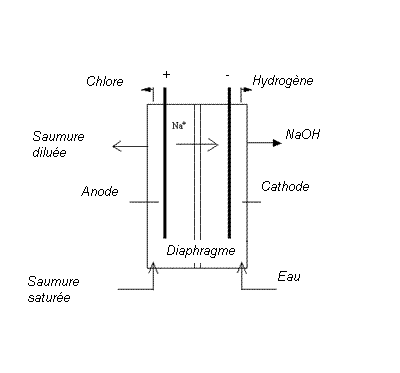
J'ai effectué récemment un TP qui consistait à étudier un procédé chlore/soude à membrane selon le montage suivant (cf image)
Le suivi de l'électrolyse se fait par un dosage de la soude à intervalle de temps régulier.
En traçant n(soude) = f(t), on obtient une fonction linéaire.
De même pour le rendement faradique.
La quantité de soude formée augmente linéairement avec le temps donc c'est cohérent.
A la fin de l'électrolyse, on fait le dosage de tout le Cl2 formé et de la soude.
On obtient les rendements suivants :
R(Cl2) = 80%
R(NaOH) = 70%
On produit plus de chlore que de soude, mais pourquoi ?
Les défauts de rendements sont dues :
- réactions parasites : oxydation de l'eau, du sodium
Pouvez-vous m'expliquer s'il vous plaît ?
-----



