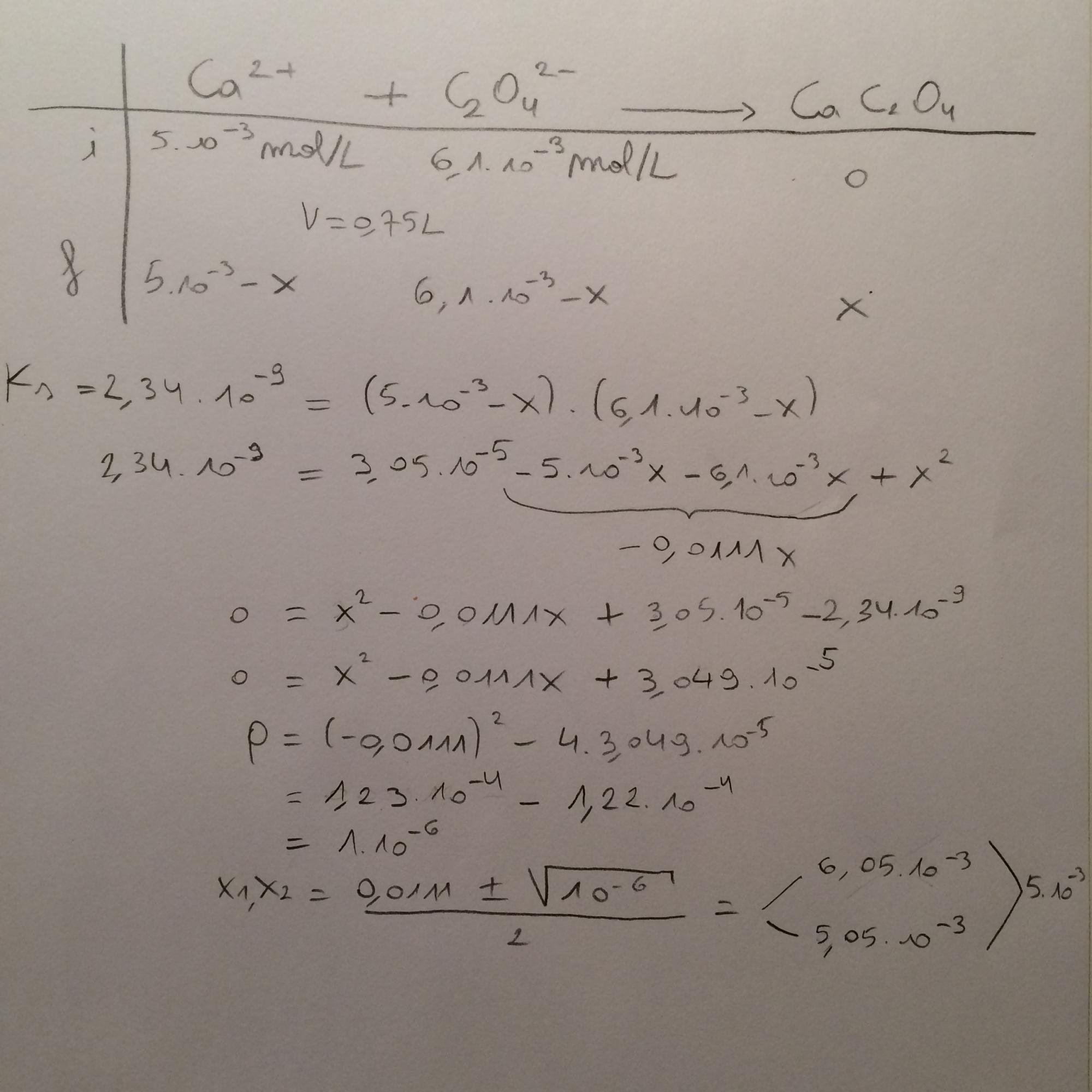Bonjour,
J'ai un peu de mal avec les précipitations, je ne vois pas vraiment comment m'y prendre pour cet exercice par exemple :
"Les calculs rénaux sont formés de CaC2O4(s). Dans 750 mL d'une solution aq. dont [Ca++] = 5.10^-3 mol/L, on ajoute assez de (NH4)2C2O4(s), pour avoir [C2O4--]initiale = 6,10.10^-3 mol/L.
Calculez les concentrations en Ca++ et C2O4-- restantes en solution sachant que Ks de CaC2O4 = 2,34.10^-9."
J'ai essayé de faire un tableau d'avancement en ne gardant que Ca++ + C2O4-- -> CaC2O4(s). Je considère les concentrations ci-dessus comme celle initiales et pour trouver celles finales, j'ai fait 5.10^-3 - x et 6,10.10^-3 - x et puis j'ai voulu faire Ks = 2,34.10^-9 = (5.10^-3 - x).(6,10.10^-3 - x) mais en isolant x, j'arrive à 2 valeurs ... Donc je suppose que c'est pas la bonne technique
Merci d'avance pour votre aide !
-----