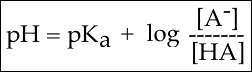Bonjour à tous,
Je bloque sur une question à propos des solutions tampons. Imaginons que nous ayons une solution aqeuse avec 1M de CH3COOH et 1M de CH3COONa.
Selon l'équation de Henderson-Hasselbalch, le pH de la solution est égal au pKa, ici 4,75.
Je ne comprends pas. N'y a-t-il pas autant de H+ donnés que de H+ acceptés ? Sinon les concentrations de l'acide et sa base conjuguée changeraient.
Alors pourquoi est-ce une solution acide et non neutre?
-----