Hello,
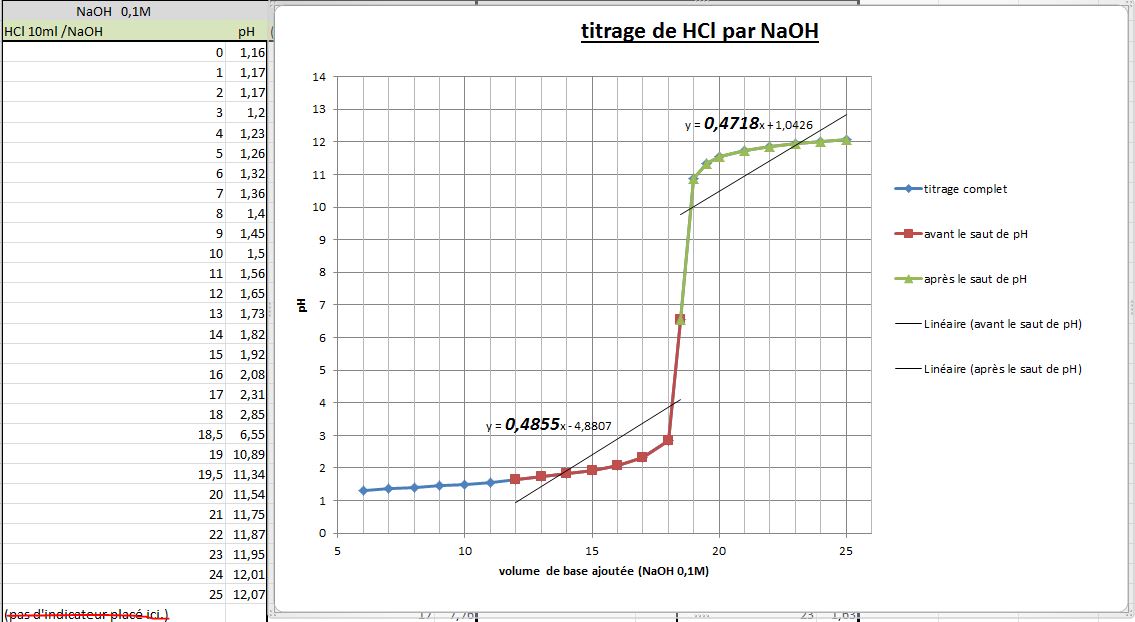
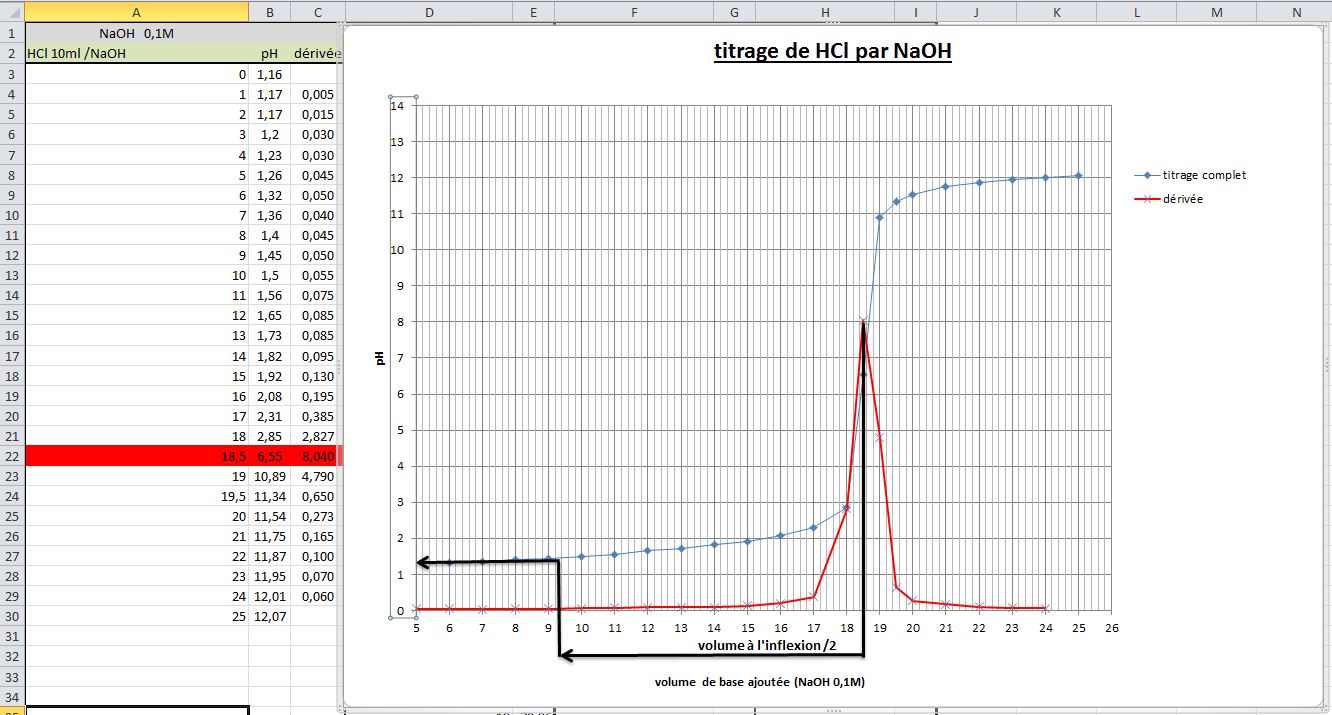
J'ai fait un bête titrage lors d'un TP avec un PH-mètre, j'ai relevé minutieusement le pH pour chaque 0.1 mL surtout lors de l'équivalence.
Mon but est de déterminer l'acide que c'est à l'aide de son pka. Comment puis-je, avec excel, trouver la demi-équivalence ? On m'a dit avec un graphique excel et la dérivée...est-ce facile ?
merci beaucoup !
-----