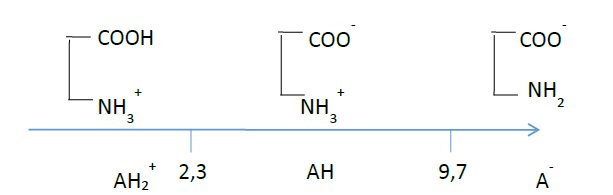
Hello, si par exemple on me demande de trouver le pH d'une solution d'un litre à 0.1M de sel de sodium de l'alanine, cela pourrait être simple si je n'avais pas deux pKa :
pKa1 = 2.3
pKa2 = 9.7
J'ai un schéma censé m'aider :
Ma prof apparemment a choisi le 9.7 et pas l'autre pour son calcule..help?
merci beaucoup !
-----