Bonjour,
Je me renseignais sur les principes de fluorescence et de phosphorescence et quelques questions me sont venues. Je comprends bien que suite à absorption d'énergie l'atome passe dans un état excité, qu'en revenant à son état fondamental il dégage de l'énergie sous forme de luminescence (arrêtez moi si je me trompe). Les molécules phosphorescentes quand à elle passe par un état intermédiaire, dit triplet via un "couplage inter-système". C'est ici que mes questions se posent.
La phosphorescence est donc un "mécanisme concurrentiel" de la fluorescence ? Qu'est ce que le couplage inter-système (si j'ai bien lu on observe une inversion de spin ?) ? La principale différence entre ces deux mécanismes est le temps de vie ? (plus long pour la phosphorescence)
Je m'excuse d'avance si il y a doublon et que ce sujet a déjà été abordé ainsi que des possibles énormités que j'ai pu sortir (sait-on jamais), et je vous remercie de vos potentielles réponses.
Taupette.
-----





 en fait ta molécule doit déjà être apte à fluorescer (il s'agit de molécule avec un fluorophore (surtout des cycles aromatiques bloqués entre eux car le blocage empêche la rotation de ta molécule donc le relarguage d'énergie sous forme de chaleur). Cette molécule absorbe de l'énergie photonique et s'excite en passant de l'état fondamental S0 à un état singulet S1 ou S2 (plus grande énergie). L'état singulet est formé de plusieurs niveaux vibrationnels, eux mêmes divisés en niveaux rotationnels (qui ont d'ailleurs leur importance en IR mais c'est une autre question ^^').
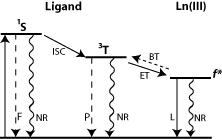
en fait ta molécule doit déjà être apte à fluorescer (il s'agit de molécule avec un fluorophore (surtout des cycles aromatiques bloqués entre eux car le blocage empêche la rotation de ta molécule donc le relarguage d'énergie sous forme de chaleur). Cette molécule absorbe de l'énergie photonique et s'excite en passant de l'état fondamental S0 à un état singulet S1 ou S2 (plus grande énergie). L'état singulet est formé de plusieurs niveaux vibrationnels, eux mêmes divisés en niveaux rotationnels (qui ont d'ailleurs leur importance en IR mais c'est une autre question ^^').  . J'ai une autre question quand à ce diagramme d'énergie :
. J'ai une autre question quand à ce diagramme d'énergie :