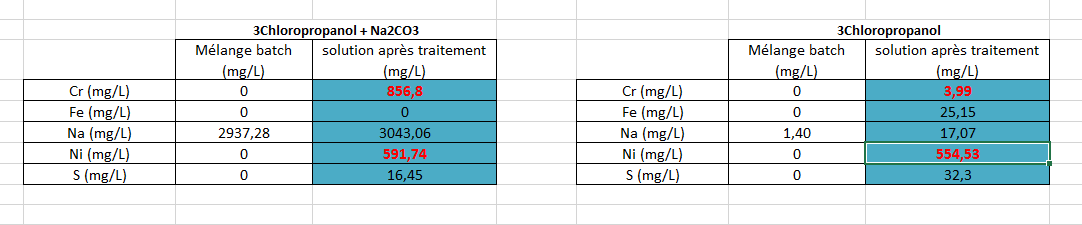
Nous avons quantifier la corrosion dans un réacteur fermé lors d'une réaction d'oxydation dans de l'eau supercritique.
On a fait 2 expériences, une avec eau + solvant chloré + eau oxyénée (oxydant), et une autre en rajoutant du Na2CO3 dans l'idée de réduire la corrosion.
On a ensuite fait une spectro plasma et receuillit la concentration des principaux éléments qui constituent l'alliage du réacteur.
Voici les résultats, le tableau de droite correspond à la 1ère expérience (1ere colonne avant réaction,2ème une fois la réaction terminée), celui de gauche à la 2eme.
La concentration en chrome augmente fortement lors de la deuxieme experience alors qu'elle devrait logiquement diminuée.
Voyez vous une explication possible à cela ?
Merci
-----