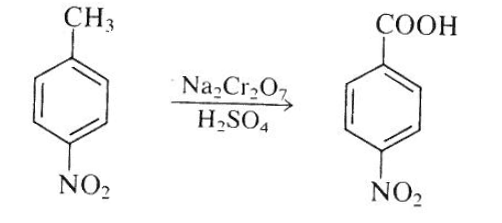Bonjour,
Je viens de voir les réactions d'oxydo-réduction en cours et je voulais utiliser ces connaissances pour comprendre ce que je fais en pratique mais je ne comprends pas trop..
C7H7NO2 + Na2Cr2O7 => C7H5NO4
J'aurai tendance à dire que c'est une oxydation, comme le carbone reçoit des O mais je n'ai aucune idée de comment calculer le nombre d'oxydation du carbone, si on peut à partir de la simple formule brute ?
-----