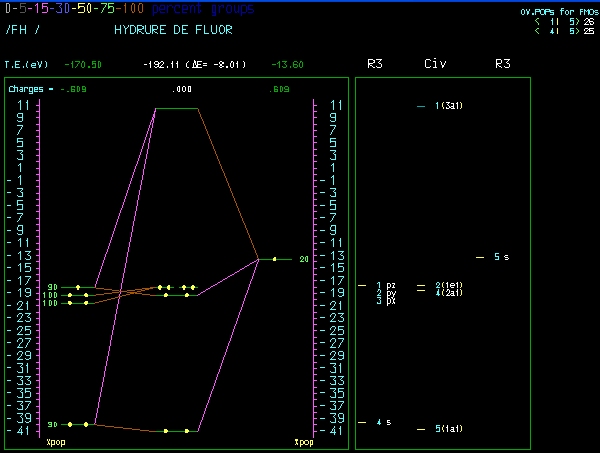
Bonjour,
J'aurai deux questions s'il vous plait :
1. Comment fait-on pour représenter les orbitales atomiques de l'atome de fluor ?
2. Et les diagrames orbitales moléculaires de HF ? tout en sachant que 1s(H) = - 13,6 eV et 2s(F) = - 37,9 eV
J'ai vraiment du mal avec ce type de question,
merci !
-----