Bonjour!
Je souhaiterai savoir si mes suppositions sont justes:
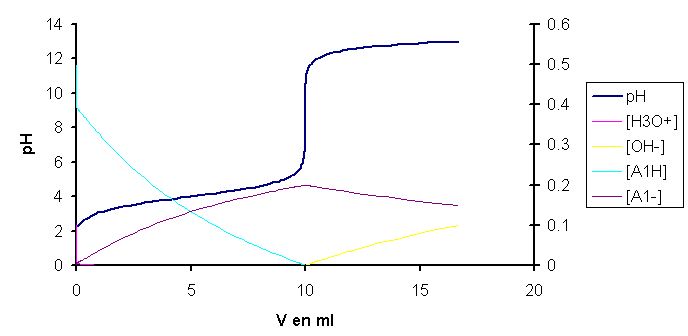
Dans un titrage d'acide faible par une base forte:
Ach + H2O <--> H3O+ + Ac-
La concentration de H3O+ diminue de cette manière:
- l'action de la base forte diminue le nombre de mole de H3O+ car OH- + H3O+ --> H2O
- mais cette diminution est compensée par la fait que la réaction est déplacée à droite (Ach + H2O --> H3O+ + Ac-) Est-ce juste?
Donc Concentration de H3O+ diminue peu fortement avant PE? Est-ce juste?
A l'inverse pour un titrage acide et base fort la concentration de H3O+ diminue plus fortement car l'équilibre est déjà complètement déplacé.
Pourriez- vous dire si mon raisonnement est bon, si non pourriez- vous me corriger...
Merci par avance!
Tim0023
-----




 ...
...