Bonjour,
Je cherche à résoudre un exercice sur un DM qui me pose problème depuis un moment.
Voici la première partie du sujet, celle sur laquelle je suis pour le moment :
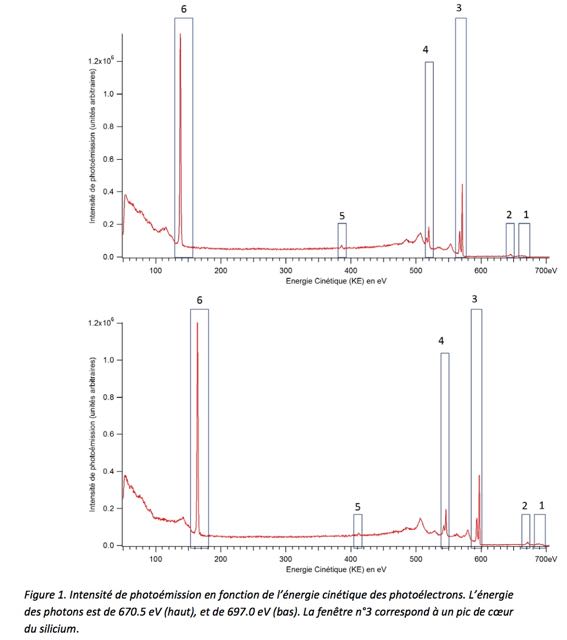
En utilisant des analyseurs d'électrons performants, on peut recueillir des photoélectrons émis à partir d'une surface irradiée par un flux de photons monochromatiques. La Figure 1 montre deux spectres larges de photoémission mesurés sur une plaquette de silicium, qui est le matériau de base de la nano-électronique. Ces spectres donnés en énergie cintique ont été mesurés à deux énergies de photons 670.5 eV et 697.0 eV. Dans les spectres de la figure 1, on voit des pics numérotés 1 à 6. Ce sont des électrons issus de niveaux atomiques de cœur et de valence.
1. Lorsque l'énergie des photons change, que remarquez-vous dans les positions énergétiques des structures numérotées présentes dans les deux spectres ?
2.Calculer l'énergie d'ionisation IE de chacun des pics 1 à 6. Cette énergie d'ionisation est aussi appelée énergie de liaison (en anglais « binding energy », BE). Cette énergie d'ionisation dépend-elle de l'énergie des photons ?
3. Trouvez les orbitales atomiques auxquels correspondent les pics 1 à 6.
Pour cette question, on nous oriente vers cette page http://techdb.podzone.net/xps-e/ pour chercher des tables d'énergie de liaison
4. Quelles sont les espèces chimiques présentes à la surface ? Expliquez pourquoi elles s'y trouvent.
Pour la première question, ça va, il faut remarquer que la différence d'énergie entre les deux photons se retrouve sur les graphes par un décalage de la même valeur sur les pics.
Pour la seconde question, j'ai les énergies cinétiques suivantes par lecture graphique :
P1=690ev
P2=670ev
P3=600ev
P4=545ev
P5=410ev
P6=160ev
Ce qui me donne avec la formule Ei=hΥ-Ec :
Ei,1=7ev
Ei,2=27ev
Ei,3=97ev
Ei,4=152ev
Ei,5=287ev
Ei,6=537ev
Arrive la troisième question qui me pose problème.
J'ai la structure électronique du silicium 1s2 2s2 2p6 3s2 3p2. Le silicium à 14 électrons répartis sur les couches K, L et M.
Mais je ne vois pas comment s'utilise cette page internet, c'est là que ça bloque!
Pourriez-vous m'aider?
Merci
-----


