Bonjour !!
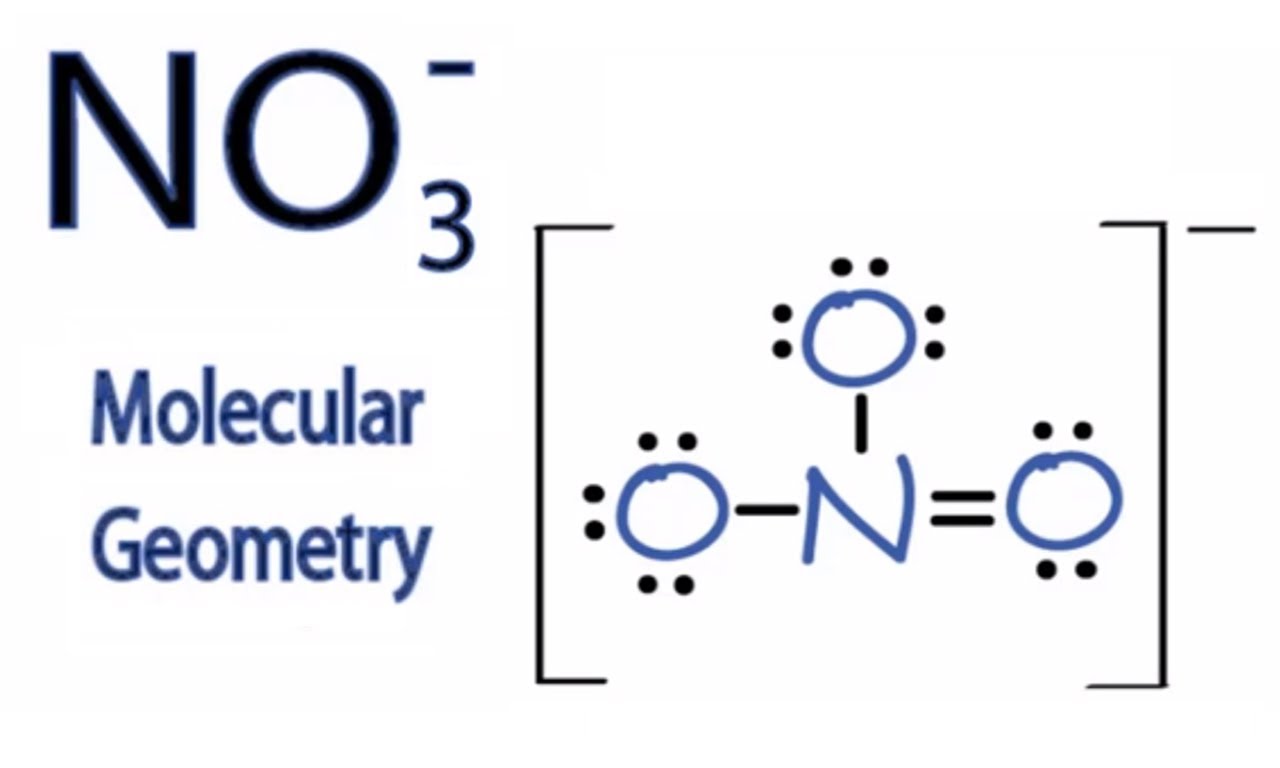
J'essaye de comprendre la structure de "NO3(-)" mais je ne vois pas du tout pourquoi 1 seul oxygène a une double liaison...
Pour moi, si la charge se met sur toute la molécule, il ne devrait y avoir qu'un atome a simple liaison (Car 1 seul électron en plus), or il y en a deux
Merci d'avance !
-----