Bonjour, je suis étudiant en biologie et je sais pas trop où poser ma question qui est à l'interface entre la biochimie et la chimie mais je pense avoir plus de chance en section chimie ^^
Je travaille sur la phosphatase alcaline dans le cadre d'un TP et je tente de comprendre le mécanisme réactionnel de l'hydrolyse du PNPP en PNP + Pi.
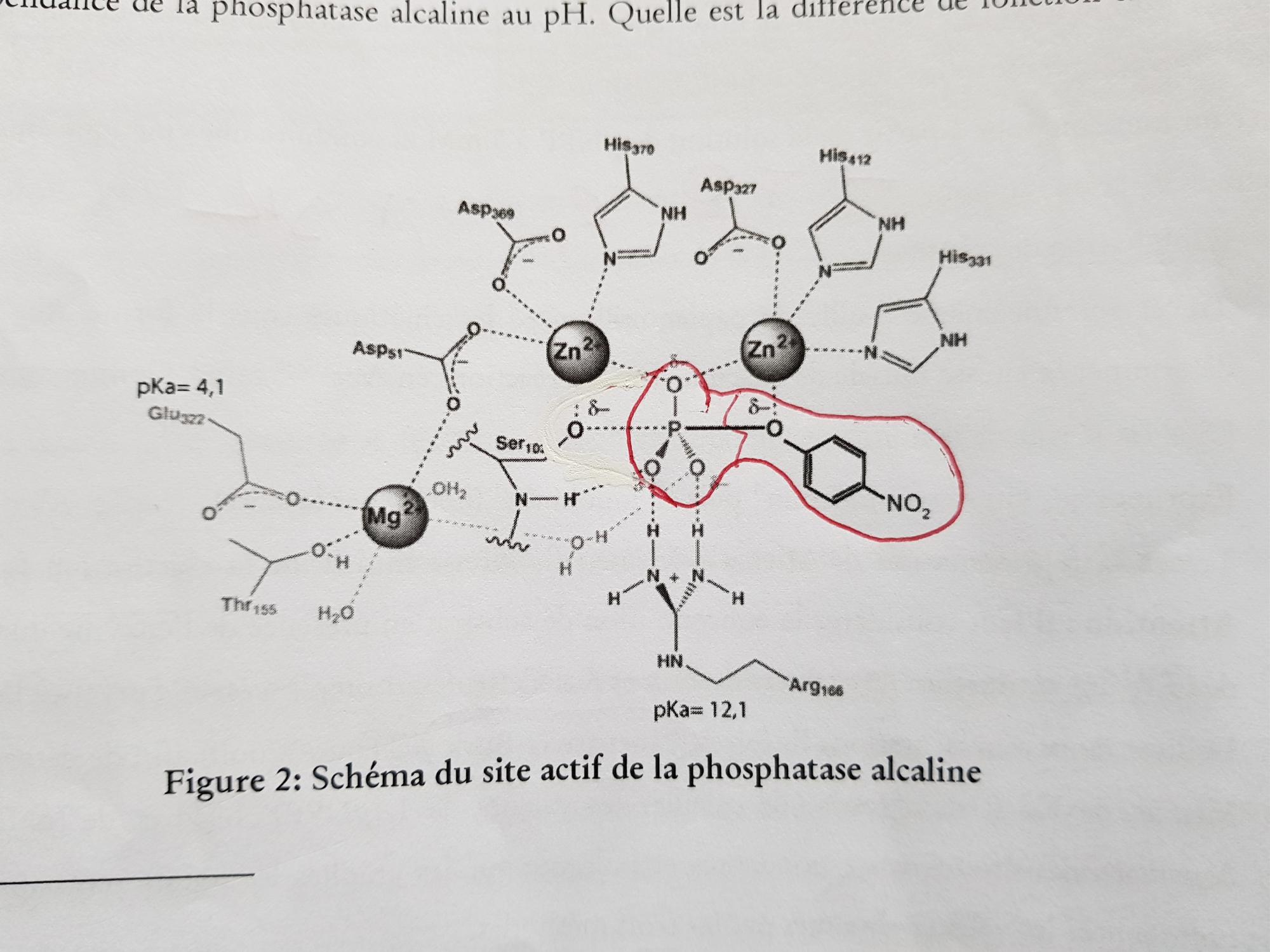
Voilà le site actif de l'enzyme avec en rouge le substrat PNPP, j'ai l'impression de reconnaître une substitution nucléophile de type SN2 avec la formation d'un état de transition et d'une molécule plane (le phosphate), le nucléophile serait la fonction alcool du résidu sérine, l'électrophile serait le phosphore du phosphate possédant une charge partielle positive et le groupe partant serait donc le PNP ?
Mais alors où intervient l'eau qui est indispensable dans une réaction d'hydrolyse ?
Quels sont les rôles des deux atomes de Zinc et de Magnésium ? Établir la structure du site actif par l'établissement de complexes de coordination avec les acides aminés ?
Merci à ceux qui pourront m'éclairer
-----