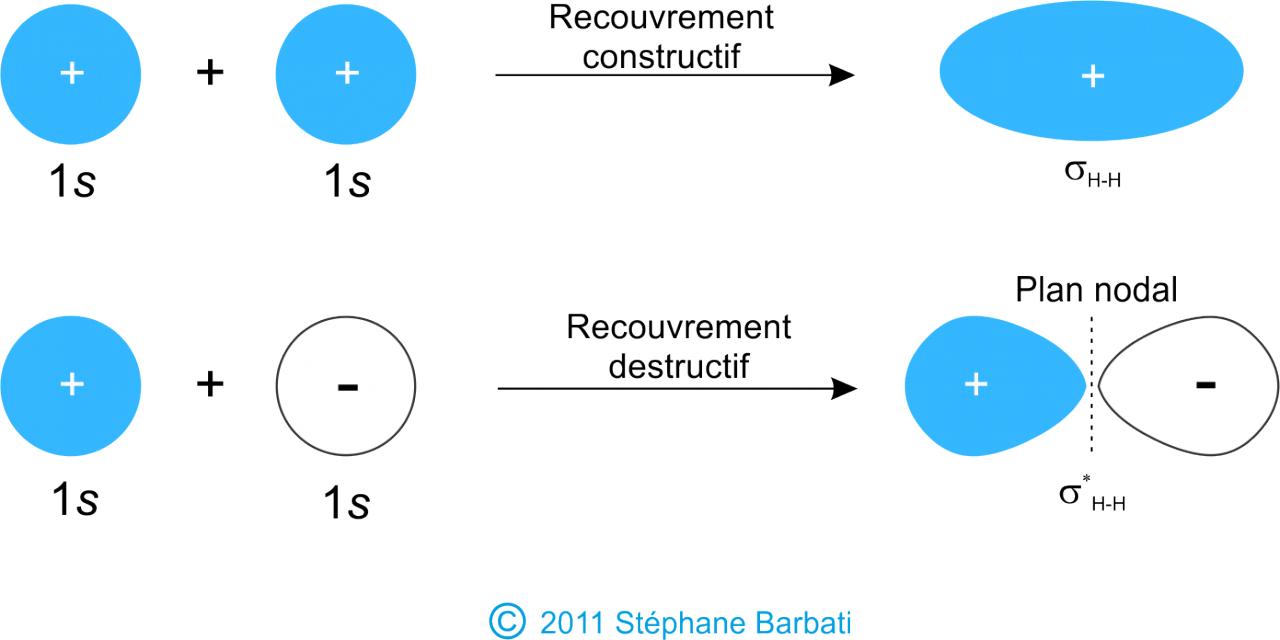
Bonjour;
voila je travaille sur mon cours de liaison chimique et il y a une chose que je n'arrive pas vraiment a concevoir proprement je sais que un orbitale moléculaire est une combinaison linaire des orbitales atomique et la combinaison de deux orbitales atomique par exemple (le modèle le plus simple le molécule H2 ) ne permet d'avoir deux orbitales puisque la combinaison d'un nombre d'orbitale atomique ne permet d'avoir le mémé nombre d'orbitale moléculaire cette expression je peux la comprendre mathématiquement mais schématiquement !!! ca me dit rien et je n'arrive pas a comprendre les schéma que je trouve dans le navigateur puisque il y a bien une liaison mais ou sont les orbitale moléculaire comme exemple voila cette photo

-----