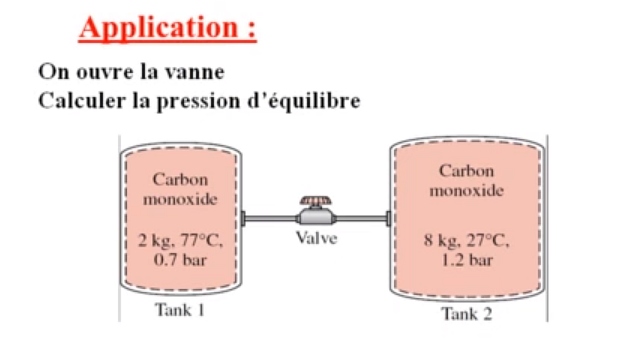
Bonjour à tous,
déjà je savais pas si de la thermodynamique ça se poste sous Physique ou Chimie (et donc au pif j'ai choisi chimie)
J'essayais de résoudre le pbme à priori simple proposé en fin de cette video: à 22'30''
https://www.youtube.com/watch?v=Z1smaI2lK88
Avec la relation PV=m.r.T j'ai calculé les volumes V1 et V2, donc V=V1+V2 total
Idem avec PV=n.R.T j'ai pu trouvé les quantités de matière n1 et n2 , et donc n=n1+n2 total
Sauf que pour trouver la pression P totale (avec P.V=n.R.T par exemple), je sais pas comment obtenir la nouvelle t° T totale ??
Qu'est ce qui me manque ?
-----