Bonjour, j'aimerais tenter de comprendre et de finir de résoudre un exercice avec vous:
voici l'énoncé: On désire cristalliser par évaporation du chlorure de sodium dissous dans une saumure. on utilise pour cela un cristalliseur continu dont le schéma est donné en annexe. Sur ce schéma ne figure pas le circuit de chauffage nécessaire à l'évaporation de l'eau. ce cristalliseur est supposé en régime permanent dans cet exercice.
l'alimentation de l'unité se fait en A. Au niveau du filtre F, il y'a séparation entre le cristallisé humide (sortie C) et les eaux mères recyclées dans le cristalliseur dans le courant D. La cristallisation se fait par évaporation de l'eau (sortie E). Le cristalliseur et le filtre sont à la température de 55°C. La saumure en A contient 30 g de sel par kg d'eau. La température en A est de 20°C. Le sel humide en C est une bouillie (suspension liquide-solide) contenant en masse 90% des cristaux de sel et 10% de solution saturée. Le débit massique total du courant C est de 200 kg/h. Le débit massique total du courant de recyclage D est fixé à 12% du débit massique total en A.
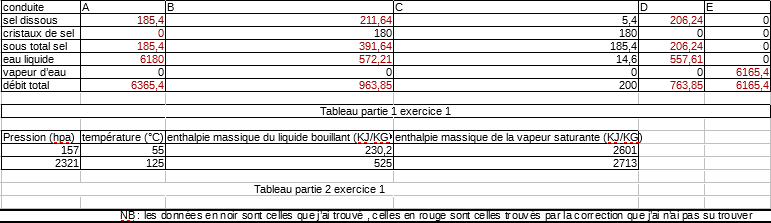
1) Recopiez le tableau ci-dessous. Avec des bilans de matières appropriés, remplir ce tableau avec les débits massiques correspondant en kg/h. Chaque valeur numérique devra être justifiée.
2) calculez la puissance thermique à fournir au cristalliseur supposé parfaitement calorifugé. Si le fluide de chauffage est une vapeur saturante sous la pression de 2321 hpa, estimez le débit massique de vapeur et la surface d'échange nécessaires à ce transfert.
données: solubilité du sel à 55°c: 370 g pour 1000 g d'eau (attention, c'est un rapport massique)
A l'état cristallisé, la formule brute du sel est bien NACL. La température d’ébullition des saumures est supposé égale à la température d’ébullition de l'eau sous la pression considéré
capacité calorifique à pression constante de la saumure: cp= 3,5 KJ/kg*k
cp est considéré indépendant du titre massique en sel de la saumure.
l'enthalpie massique des cristaux de sel est supposé égale à celle de la saumure à la température considéré
On supposera l'absence de pertes de charge dans le circuit de chauffage. En sortie de celui-ci, l'eau est supposé à l'état de liquide bouillant.
conductance global de transfert thermique: 1600 W/m^2/k
Pièce jointe 379334
pour l'instant, si l'on reste sur la question 1, il y'a 3 points que je ne comprends pas:
d'après la correction, il faut faire un bilan sur l'installation pour trouver la quantité de sel dissous en A qui est égale au sous totale de sel en C ( sel dissous + cristaux de sel) on aurait donc: Axa= Cxc+ Exe or, il n'y a que de la vapeur en E donc le bilan deviendra Axa= Cxc mais je ne comprends pas si on raisonne sur le sel pourquoi cela fait 185,4 Kg/h
ensuite, je ne comprends pas pourquoi il n'y aurait pas de cristaux de sel en A simplement parce que le titre massique en sel de A (0,029) est inférieur à celui en C (0,27)
enfin, comment connaissant cette information sur A, peut on remonter jusqu'au débit massique total en A qui est de 6365,4 Kg/h
pouvez vous m'aider à mieux comprendre ces éléments ?
merci d'avance
-----