Bonjour,
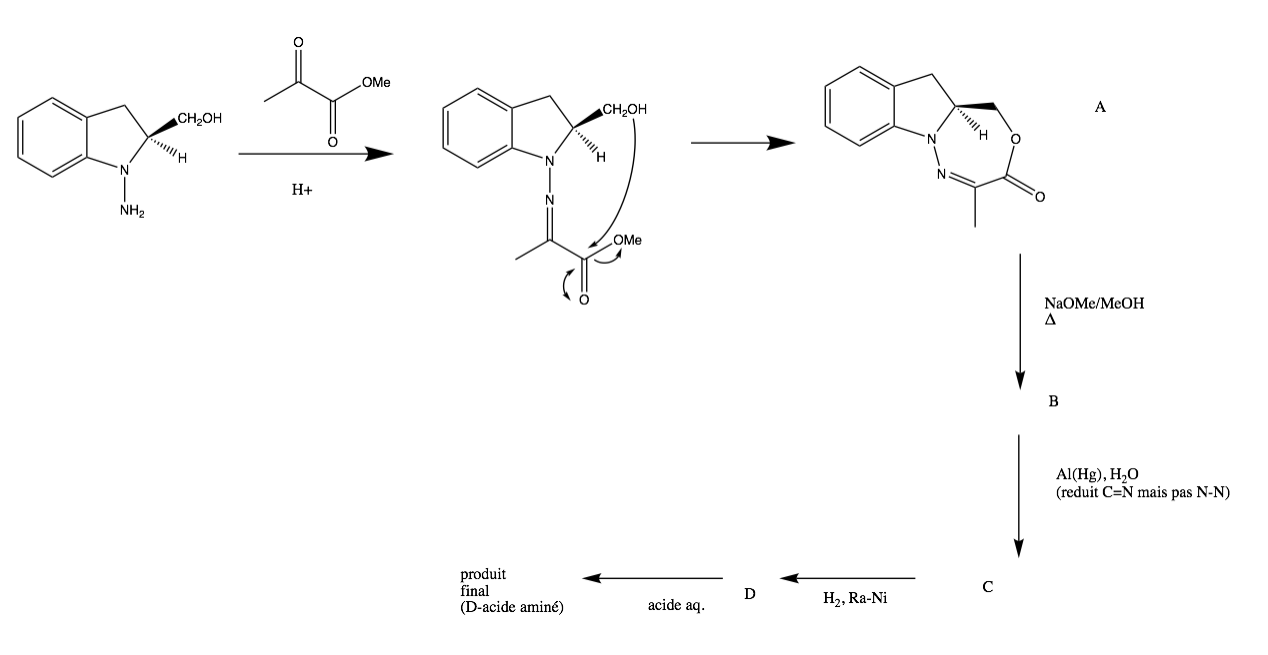
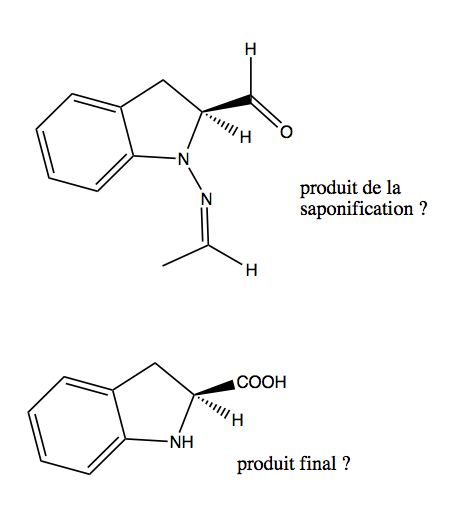
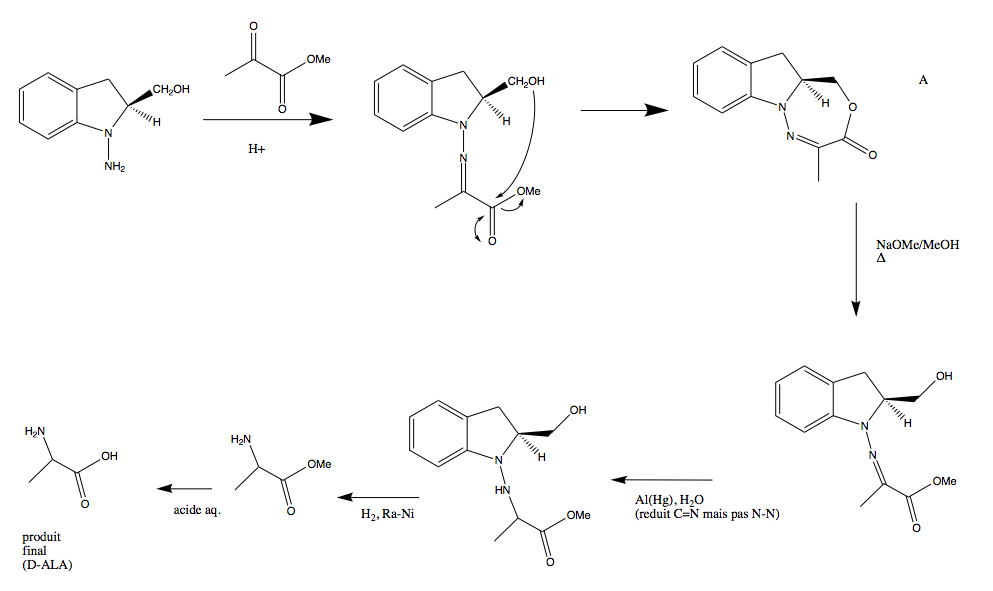
J'ai un exercise qui me pose soucis, pour changer... Il est question de fournir la structure des composés intermédiaires et celle du produit final de la synthèse d'un acide aminé D partant d'un auxiliaire chiral. Je bloque dès le départ : ce que je propose doit surement être du domaine de la fantaisie, car je doute fort qu'il puisse se former un cycle à 7 membres... Est-ce que l'amine attaque l'autre carbonyle du méthyl pyruvate? J'ai tenté et dans les deux cas ça ne mène à rien...
De l'aide siouplait ?
-----