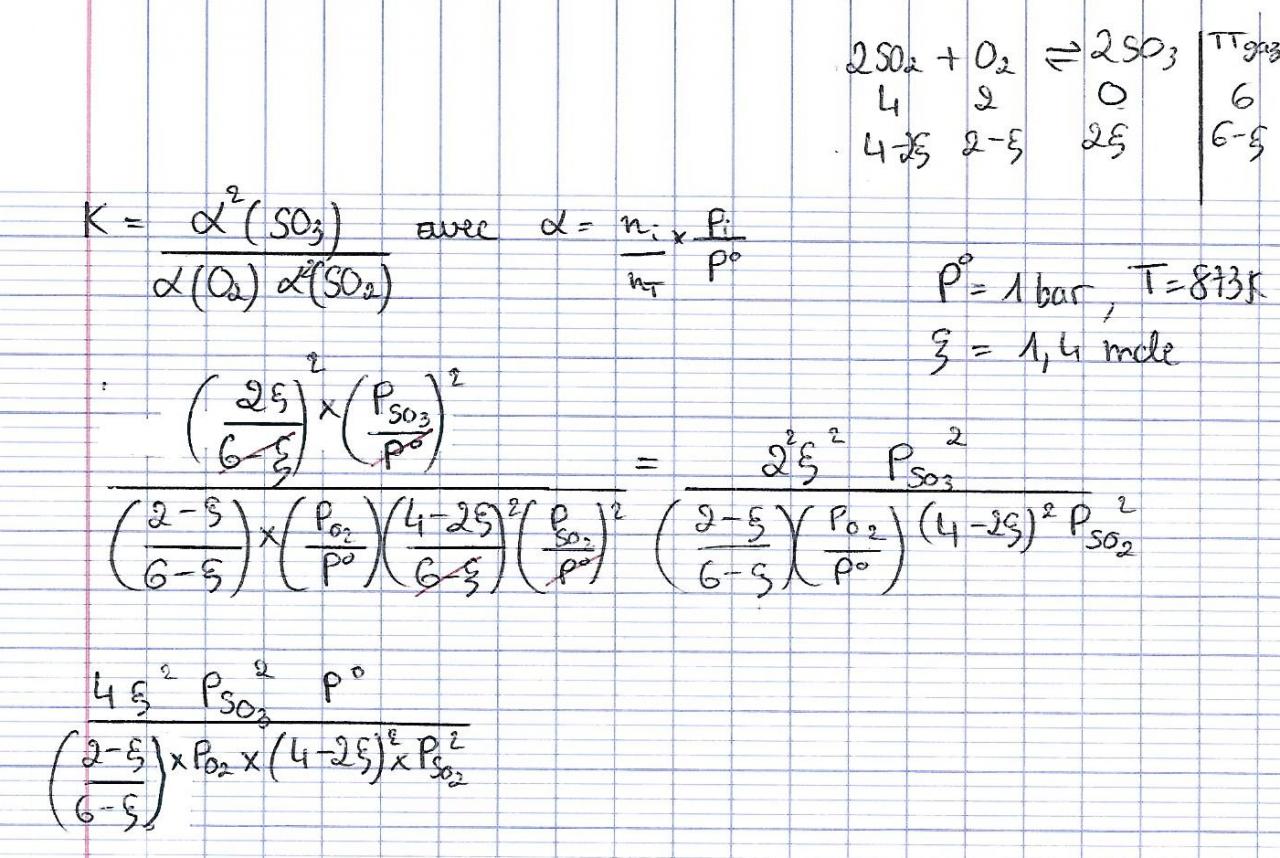Bonsoir,
Soit la réaction 2 SO2 + O2 <-> 2 SO3
On souhaite créer un équilibre chimique en augmentant la température.
Il y a 4 moles de SO2 et 2 moles de O2
1) Je dois calculer la constante Kp sachant que Ptot = 1 bar, T = 873K et que ξ = 1,4 mol
J'ai commencé à écrire que Kp=Q (quotien réactionnel, car on cherche à créer un équilibre)
Kp= ((ξ/6-ξ)^2) (P/P0)^2 / (2-ξ/6-ξ)(P/P0)(4-ξ/6-ξ)^2 (P/P0)^2
Kp = ξ^2 P0 / P (2- ξ/6-ξ)(8-ξ^2)
J'ai donc pensé qu'il faudrait juste calculer P sachant que PV=nRT mais malheureusement je ne vois pas comment faire car nous n'avons pas de volume
2) Il faudrait calculer l'entropie.
Je sais que ΔS°= (Δ°H- ΔG)/T
Je sais que pour trouver ΔG° il faut trouver Kp car - ΔG° = RT ln Kp mais ensuite pour ΔH° je ne sais pas comment trouver.
Si vous pourriez m'aider à me mettre sur la voie s'il vous plaît.
-----



 )
)